题目内容
溶液的碱性强弱跟溶液中OH-的数量有关.一定体积的溶液中OH-数量越多,则溶液碱性越强.100m1 10%的NaOH溶液(密度为1.1g/cm3)与100m110%的KOH溶液(密度也为1.1g/cm3)相比较,碱性更强的是
- A.NaOH
- B.KOH
- C.一样强
- D.无法比较
A
分析:要比较溶液的碱性强弱,就要比较等体积的10%的NaOH溶液与10%的KOH溶液中OH-数量.根据一定体积的溶液中OH-数量越多溶液碱性越强,判断10%的NaOH溶液与10%的KOH溶液碱性的强弱关系.
解答:假设两种溶液的体积都为vmL
vmL10%的NaOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)× ×100%=0.04675v
×100%=0.04675v
vmL10%的KOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)×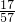 ×100%=0.03282v
×100%=0.03282v
由于0.0467gv>0.03282v,所以,10%的NaOH溶液的碱性比10%的KOH溶液的碱性强;由以上计算可知,A正确,B、C、D错误.
故选A.
点评:在计算溶液中的OH-的数量时,把NaOH、KOH中的氢氧根看成一个整体(或一种元素),可计算其中氢氧根离子的质量分数.
分析:要比较溶液的碱性强弱,就要比较等体积的10%的NaOH溶液与10%的KOH溶液中OH-数量.根据一定体积的溶液中OH-数量越多溶液碱性越强,判断10%的NaOH溶液与10%的KOH溶液碱性的强弱关系.
解答:假设两种溶液的体积都为vmL
vmL10%的NaOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)×
 ×100%=0.04675v
×100%=0.04675vvmL10%的KOH溶液中所含OH-数量=(vmL×1.1g/cm3×10%)×
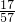 ×100%=0.03282v
×100%=0.03282v由于0.0467gv>0.03282v,所以,10%的NaOH溶液的碱性比10%的KOH溶液的碱性强;由以上计算可知,A正确,B、C、D错误.
故选A.
点评:在计算溶液中的OH-的数量时,把NaOH、KOH中的氢氧根看成一个整体(或一种元素),可计算其中氢氧根离子的质量分数.

练习册系列答案
相关题目
