题目内容
【题目】向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图.据图回答:
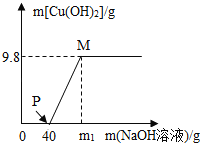
(1)在滴加NaOH溶液过程中,原溶液中 离子个数不变.(填离子符号)
(2)P点溶液中的溶质是 .
(3)m1的值为 .
(4)M点溶液中的溶质质量分数是多少?
【答案】(1)Cl﹣;(2)NaCl CuCl2.(3)120;(4)8.3%
【解析】(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由化学方程式可以看出,在此整个过程中,氯离子数目不变.
(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl CuCl2
(3)设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为x,生成氯化钠的质量为z
CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
80 98 117
x×10% 9.8g z
![]()
x=80g
z=11.7g
氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+80g=120g
(4)设氯化氢与氢氧化钠反应生成氯化钠的质量为y
NaOH+HCl═NaCl+H2O
40 58.5
40g×10% y
![]()
y=5.85g
M点溶液中的溶质氯化钠的质量为11.7g+5.85g=17.55g
M点溶液的溶质质量分数=![]() ×100%≈8.3%
×100%≈8.3%
答:M点溶液的溶质质量分数为8.3%

练习册系列答案
相关题目