题目内容
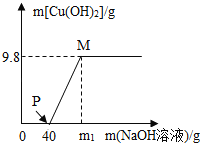
【题目】某科学小组为了测定石膏的组成(CaS04.xH20),即测x值,做了如下实验:将含结晶水的硫酸钙放在钳锅中加热,加热前和加热后都进行称量.随着实验次数的增加,加热的时间不断延长.他们在实验中将数据整理如表.利用数据可绘制成如图的图象:

(1)用实验数据,推断生石膏的化学式 ;
(2)分析图象中产生AB段的原因 .
【答案】(1)CaSO42H2O;(2)原因是石膏的质量为2.90g,根据图中数据可知最后固体质量不变,说明已经没有了结晶水,即CaSO4质量为2.72g,所以H2O的质量为2.90g﹣2.72g═0.18g.则硫酸钙与水的质量比为:272:18,因为硫酸钙与水的相对分子质量比为136:18,所以硫酸钙前面应该放上2,所以此时其化学式可表示为2CaSO4H2O.该物质化学性质稳定,受热不易分解.
【解析】(1)解:石膏加热分解减少的质量就是水的质量,由实验数据知3.44g CaSO4xH2O完全分解得到无水CaSO42.72g,则:
CaSO4xH2O═CaSO4+xH2O
136 18x
2.72 0.72
即136:2.72=18x:0.72
解得x=2 所以石膏的化学式为CaSO42H2O.
(2)由实验数据知在A﹣B段时石膏的质量为2.90g,其中CaSO42.72g,H2O0.18g.此时其化学式可表示为2CaSO4H2O.

 初中学业考试导与练系列答案
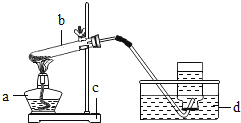
初中学业考试导与练系列答案【题目】为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图.每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表.(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
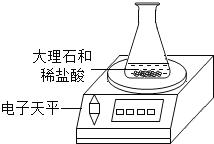
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? .
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: .
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)