题目内容
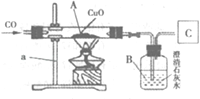
【题目】某地岩石以石灰岩为主,石灰石储量达50亿吨,是制造水泥、石灰、轻质碳酸钙的主要原料来源.某校科学探究小组同学把一块从山上捡来的石灰石做纯度分析,进行了如下实验:
①用天平准确称取30克石灰石放入甲图A装置中,同时加入足量稀盐酸;
②测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并据此绘成乙图中的曲线;
③根据实验结果计算该石灰石的纯度.
请分析回答下列问题:

(1)根据实验数据计算该石灰石中CaCO3的质量分数.
(2)忽略空气中二氧化碳及盐酸挥发对实验结果的影响,由C装置测得的二氧化碳质量与实际反应产生的二氧化碳质量并不相等.试分析原因可能是 ;请说说你的改进措施 .
【答案】(1)该石灰石中CaCO3的质量分数为50%;(2)AB容器内还有剩余的二氧化碳没有完全被氢氧化钠吸收;从长颈漏斗鼓入氮气,将二氧化碳全部排出.
【解析】(1)设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g
![]()
x=15g
该石灰石中CaCO3的质量分数为:![]() ×100%=50%;
×100%=50%;
(2)AB容器内可能还有剩余的二氧化碳没有完全被氢氧化钠吸收,故由C装置测得的二氧化碳质量与反应产生的二氧化碳质量不相等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图.每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表.(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
大理石碎屑生成的CO2质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
块状大理石生成的CO2质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
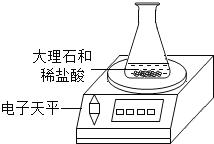
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? .
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由: .
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)