题目内容
【题目】某同学要配制10g质量分数为16%的氯化钠溶液,步骤如下,请回答下列问题:

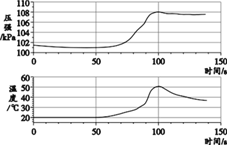
(1)用托盘天平称取氯化钠_____g.应选用_____(填10mL、20mL、50mL或100mL)量筒量取所需要的水。
(2)C操作中用到玻璃棒的作用是_____。
(3)某同学实际配制的氯化钠溶液中溶质的质量分数小于16%,可能的原因是_____。
A 量取水时仰视读数
B 称量氯化钠固体时把砝码放在左盘(小于1g的质量移动游码)
C 配制溶液的烧杯用少量蒸馏水润洗
D 把已配好的溶液转移到细口瓶贮存时,有少量溶液溅出
(4)D中所贴标签有不妥之处,你认为在D后的方框中应该写的内容为_____。
【答案】1.6 10mL 搅拌,加速固体溶解 ABC 
【解析】
(1)氯化钠溶液中氯化钠的质量为10g×16%=1.6g;水的质量=10g﹣1.6g=8.4g,合8.4mL,应选用10mL量筒量取所需要的水;
(2)玻璃棒在该实验中所起的作用是:搅拌,加速固体溶解;
(3)A、用量筒量取水时仰视读数,量取的水体积偏大,质量就偏大,溶质质量不变,因此溶质质量分数偏小,故可能;
B、称量氯化钠固体时把砝码放在左盘,因需要用到游码,会导致称量的氯化钠偏小,溶剂质量不变,所以溶质质量分数偏小,故可能;
C、配制溶液的烧杯用少量蒸馏水润洗,会导致溶剂质量增大,因为溶质质量不变,所以溶质质量分数偏小,故可能;
D、把已配好的溶液转移到细口瓶贮存时,有少量溶液溅出,因溶液具有均一性,所以溶质质量分数不变,故不可能;
(4)标签上应该注明的是溶液的名称及溶质质量分数。

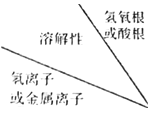
【题目】下表是碱、酸、盐的溶解性表(20℃)中的一部分,部分碱、酸、盐的溶解性表(20℃)
| OH- | SO42- | CO32- |
H+ | ① | 溶、挥 | |
Na+ | ② | 溶 | ③ |
Ca2+ | ④ | 微 | 不 |
由表中①处可知
a 应填写的内容是“溶”,表示可溶于水b 表示的物质是硫酸,化学式为H2SO4 c 属于“酸”类。
请据此回答下列有关问题:
(1)表中②处应填写的内容是_____
a 溶 b 微 c 挥 d 不
(2)表中③处物质化学式为_____属于_____(填“酸”、“碱”或“盐”)。
(3)写出表中④处物质与二氧化碳反应的化学方程式_____
(4)写出表中④处物质的一种用途_____