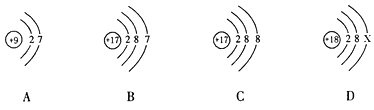
题目内容
【题目】工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2 + 6Ca(OH)2 =Ca(ClO3)2 + 5CaCl2 + 6H2O。②有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ________,该操作中玻璃棒的作用是__________。
(2)Ca(ClO3)2的名称是___________。对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为_________。
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是_____。溶液A中含有的溶质为CaCl2和_________(填化学式)。
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl-等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的___________饱和溶液(填编号)。
A KCl B CaCl2 C KClO3 D Na2CO3
【答案】漏斗 引流 氯酸钙 1:5 氯酸钾的溶解度最小 KClO3 C
【解析】
(1)过滤时需要的玻璃仪器有烧杯、玻璃棒、漏斗,该操作中玻璃棒的作用是引流;
(2)Ca(ClO3)2的名称是氯酸钙;对于反应1,氯气与氢氧化钙反应生成了氯化钙和氯酸钙,在Cl2中氯元素的化合价为0,在CaCl2中氯元素的化合价为-1价,在Ca(ClO3)2中氯元素的化合价为+5价,由于只有氯元素的化合价发生了变化,升降的总数应相同,所以化合价升高的Cl与化合价降低的Cl 的个数比为1:5;
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是:氯酸钾的溶解度最小,溶液A中含有的溶质为CaCl2和 KClO3;
(4)由于氯化钙易溶解在水中,KClO3的溶解度较小,而在饱和氯酸钾中几乎不溶,所以都可以减少氯酸钾因为洗涤而损失应用饱和KClO3溶液洗涤,故选C。