题目内容
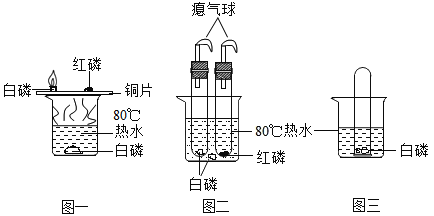
【题目】如图所示为实验室中常见的气体制取和进行相关实验的装置。
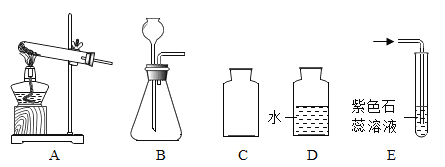
(1)实验室制取二氧化碳应选用的发生装置是_____(填标号);
(2)实验室中,若用装置 B 来制取氧气,请写出发生的化学反应方程式_____; 当用加热高锰酸钾(2KMnO4![]() K2MnO4+MnO2+O2
K2MnO4+MnO2+O2![]() )的方法制取氧气,则你选取的发生装置是_________________(填标号);该反应中锰元素的化合价由反应前的+7 价,变为反应后的+4 价和_____价。
)的方法制取氧气,则你选取的发生装置是_________________(填标号);该反应中锰元素的化合价由反应前的+7 价,变为反应后的+4 价和_____价。
(3)用已收集好的二瓶氧气 C 和D 进行“铁丝在氧气中燃烧”的实验,应在____________________(选填“C” 或“D”)中进行,观察到的实验现象是________________________________;将制取的二氧化碳气体通入装置 E 中观察到的实验现象是_________________________________________。
【答案】B 2H2O2![]() 2H2O+O2↑ A +6 D 火星四溅,生成黑色固体 紫色石蕊试液变红
2H2O+O2↑ A +6 D 火星四溅,生成黑色固体 紫色石蕊试液变红
【解析】
(1)实验室使用石灰石和稀盐酸反应生成氯化钙、水和二氧化碳制取二氧化碳,是固体和液体在常温下的反应,选择B装置制取;
(2)利用B装置制取氧气,则为过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为: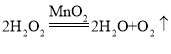 ; 当用加热高锰酸钾(
; 当用加热高锰酸钾(![]() )的方法制取氧气,选取的发生装置是A,根据化合物化合价代数和为零得出该反应中锰元素的化合价由反应前的+7 价,变为反应后的+4 价和+6价;
)的方法制取氧气,选取的发生装置是A,根据化合物化合价代数和为零得出该反应中锰元素的化合价由反应前的+7 价,变为反应后的+4 价和+6价;
(3)做铁丝在氧气中燃烧实验时,集气瓶底部装水或者沙子;铁在氧气中能够剧烈地燃烧,火星四射,生成黑色固体,放出大量的热;
(4)实验室里将制得的二氧化碳气体通入紫色石蕊中,二氧化碳和溶液中的水反应生成碳酸,酸能使紫色石蕊溶液变红。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】为了解AB两种金属在常见金属活动性顺序表中的位置,设计以下实验:
实验一 | 实验二 | 实验三 | |
实验操作 | 将AB分别伸入稀盐酸 | 将A伸入B的盐溶液中 | 将B伸入A的盐溶液中 |
实验现象 | 均无明显现象 | 红色的A表面有银白色固体析出 | ________现象 |
由上述现象可知,下列判断正确的是 ( )
A.![]() B.
B.![]() C.A、B可能是铜锌D.实验三有固体析出
C.A、B可能是铜锌D.实验三有固体析出
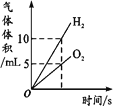
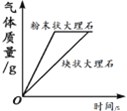
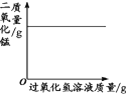
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D
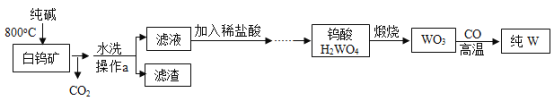
【题目】工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2 + 6Ca(OH)2 =Ca(ClO3)2 + 5CaCl2 + 6H2O。②有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ________,该操作中玻璃棒的作用是__________。
(2)Ca(ClO3)2的名称是___________。对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为_________。
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是_____。溶液A中含有的溶质为CaCl2和_________(填化学式)。
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl-等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的___________饱和溶液(填编号)。
A KCl B CaCl2 C KClO3 D Na2CO3