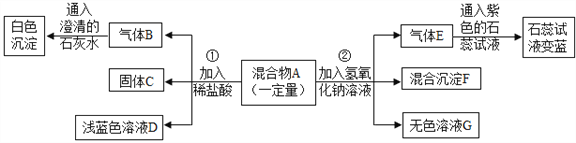
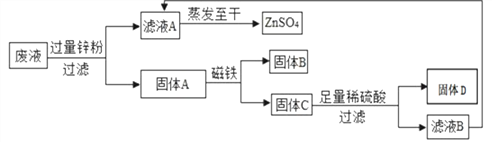
题目内容
【题目】向盛有193.8g硫酸铜溶液的烧杯中,逐滴加入质量分数为8%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示。
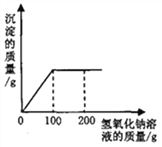
请计算:
(1)恰好完全反应时生成沉淀的质量。
(2)恰好完全反应时溶液中溶质的质量分数
【答案】(1)9.8g (2)5%
【解析】硫酸铜与氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,反应的化学方程式表示为:CuSO4+2NaOH===Na2SO4+Cu(OH)2↓,由反应的图像可知恰好完全反应时消耗的氢氧化钠溶液的质量为100g,那么100g氢氧化钠溶液中溶质的质量=![]() =8g,利用化学方程式,根据反应的质量比即可计算出生成的氢氧化铜沉淀的质量和硫酸钠的质量。设生成的氢氧化铜沉淀的质量为x,生成的硫酸钠的质量为y;
=8g,利用化学方程式,根据反应的质量比即可计算出生成的氢氧化铜沉淀的质量和硫酸钠的质量。设生成的氢氧化铜沉淀的质量为x,生成的硫酸钠的质量为y;
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
80 142 98
8g y x
![]()
![]()
x=9.8g y=14.2g
(2)恰好完全反应时溶液的质量=193.8g+100g-9.8g=284g
溶液中溶质的质量分数=![]() =5%
=5%
答:恰好完全反应时生成沉淀的质量为9.8g,反应后溶质的质量分数为5%。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目