题目内容
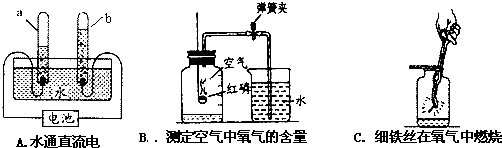
图2–3为某同学在实验室用高锰酸钾受热制氧气,并用甲、乙两种方法收集氧气的装置图。

⑴写出图中所标序号的仪器名称:
a ;b ;c ;d ;
⑵指出图中错误:① ;
② ;
③ 。
⑶用乙法收集时,检验氧气是否充满集气瓶的方法是
。
答案:⑴酒精灯 试管 铁架台 集气瓶
⑵①试管管口未向下倾斜 ②试管内导管未稍露出橡皮塞 ③乙瓶中导管未伸到瓶底
⑶将带有火星的木条伸到瓶口看是否复燃

 阅读快车系列答案
阅读快车系列答案过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H20反应生成02,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如上图(右图)所示实验装置制取氧气,请回答有关问题。
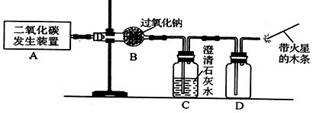
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的哪些性质?
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进?
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,请根据卷首资料提供的信息,将下表填写完整。
|
实验操作 |
现 象 |
有关的化学方程式 |
|
实验一:取少量固体样品, ______________ |
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2 O |
|
实验二:取少量固体样品,加水配成溶液,滴加适量的___________溶液 |
有白色沉淀产生
|
|
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
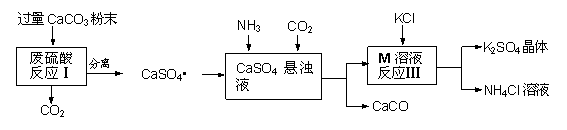 一、K2SO4的制备
一、K2SO4的制备
(1)将CaCO3研成粉末的目的是 ▲ 。
(2)上述流程中可循环使用的物质有CO2和 ▲ (填写化学式)。
(3)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是 ▲ 。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ▲ ;为检验此晶体是否洗涤干净,可取最后 一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 ▲ 。
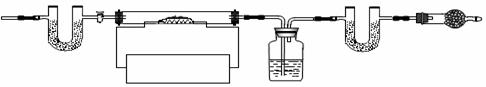
 (6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
 |
|
①实验前首先要 ▲ ,再装入样品。装置A的作用是 ▲ 。
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g

 某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲  (选填序号)两个数据组合也可求出x:y的值。
(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯
净CaSO4•2H2O固体3.44g,放在(5)的实
验装置B中进行加热,测定固体质量随温
度的变化情况如右图所示。
①G点固体的化学式是 ▲ 。
②将T2~1400℃温度段加热固体所产 生的
生的
气体
|
则H~I段发生反应的化学方程式为 ▲ 。
实验 1 回收填料中的二氧化锰和氯化铵

查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如图1所示.
(1)操作 1 和操作 2 的名称都是______,该操作中玻璃棒的作用是______.
(2)灼烧滤渣 l 的目的是______.
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度______氯化锌的溶解度(填“<”、“=”或“>”).
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水,提供装置如图 2.
①应选择:发生装置为______(填编号),排空气法收集装置为______(填编号).
②若用排水法收集并测定气体的体积,气体从装置 B 导管口______(填“a”或“b”) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是______.
(5)探究影响锌与稀硫酸反应快慢的因素.反应过程中,用前 10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表四组实验,获得数据如下表.
| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
②为了研究硫酸浓度对反应快慢的影响,需比较实验______和实验______(填编号).
③控制其他条件相同,需控制的条件是______(例举一种条件即可).