题目内容
【题目】(6分)人类生存离不开能源。
(1)南京家用燃料的更新过程如下:

①煤、液化石油气、管道煤气均属于 (填“混合物”或“纯净物”)。
②下列有关家用燃料更新的理由,不正确的是_____(填字母序号)。
A.天然气属可再生能源
B.气体燃料比固体燃料利用率更高
C.减少煤燃烧过程中产生的污染物
D.气体燃料便于管道输送
③相同条件下,气体体积比等于分子数比。现有一套以液化石油气(主要成分为C4H10)为燃料的灶具,若要改为以天然气为燃料的灶具,应采取的措施是
A.燃料气和空气的进入量都减小
B.燃料气和空气的进入量都增大
C.增大燃料气进入量或减小空气进入量
D.减小燃料气进入量或增大空气进入量
(2)乙醇(C2H5OH)是一种绿色燃料。将一定量的乙醇和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:下列判断不正确的是
物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 5.4 | 4.4 | a |
A.表中a的值为2.8
B.X可能是这个反应中的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是9.6g,则无X生成
【答案】(1)①混合物;②A;③C;(2)BC.
【解析】(1)①煤、液化石油气、管道煤气都是由不同种物质组成,属于混合物; ②天然气是不可再生的能源,比固体燃料利用率更高,燃烧过程中产生的污染物较少,天然气燃料便于管道输送,故A错误,B、C、D正确;③同体积的两种燃气,液化石油气耗氧量多,天然气耗氧量少,把液化石油气为燃料的灶具改用天然气为燃料时,需要减少空气的量,增加天然气的进入量.故填:C.
(2)根据质量守恒定律可知,参加反应的乙醇和氧气质量和是:4.6g+8g=12.6g,生成的水和二氧化碳的质量和为:5.4g+4.4g=9.8g,则生成的X的质量为:12.6g-9.8g=2.8g,则表中a的值为2.8,X不可能是这个反应中的催化剂;根据质量守恒定律,由乙醇和水中氢元素的质量都是0.6克,则说明X中不含有氢元素;根据乙醇燃烧的方程式可知,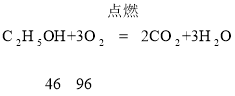 ,4.6g乙醇与9.6g的氧气恰好完全反应,生成了二氧化碳和水,不会生成X,故AD 正确.
,4.6g乙醇与9.6g的氧气恰好完全反应,生成了二氧化碳和水,不会生成X,故AD 正确.
试题分析:(1)①根据煤、液化石油气、管道煤气都含有不同种物质组成,属于混合物; ②根据天然气是不可再生的能源,比固体燃料利用率更高,燃烧过程中产生的污染物较少,天然气燃料便于管道输送分析;③根据同体积的两种燃气,液化石油气耗氧量多,天然气耗氧量少,把液化石油气为燃料的灶具改用天然气为燃料时,需要减少空气的量,或增加天然气的进入量分析;
(2)根据质量守恒定律可知,参加反应乙醇与氧气质量之和等于反应后生成的二氧化碳和水及X的质量之和计算X值;根据X反应前后的质量变化,结合催化剂的特点分析;根据表格中的数据,计算乙醇和水中所含氢元素的质量,由氢元素质量守恒推断X是否含有氢元素;根据乙醇完全燃烧的方程式,先确定乙醇和氧气的质量比,根据9.6g氧气恰好与4.6g乙醇反应,没有X生成进行分析.

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案