题目内容
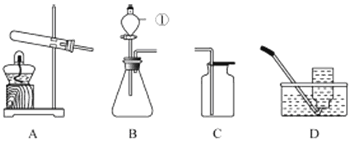
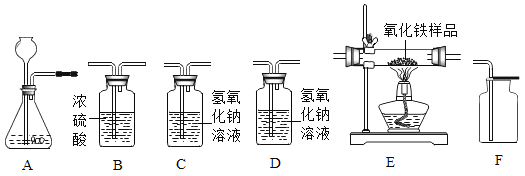
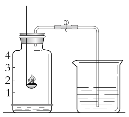
【题目】某实验小组用图所示装置测定空气中氧气的含量。
(1)该实验中红磷燃烧的文字表达式为_____。
(2)该实验操作的正确顺序是_____(填数字序号)。
① 用弹簧夹夹紧胶皮管。
② 待红磷熄灭并冷却至室温后,打开弹簧夹。
③ 点燃红磷,立即伸入瓶中并把塞子塞紧。
④ 检验装置的气密性。在集气瓶中加入少量水,并将水面上方空间分成5等份。
(3)能说明空气中氧气含量的现象是_____。
(4)下列操作可能导致测定结果偏高的是_____(填字母序号,下同)。
A 红磷的量不足 B 点燃红磷,慢慢伸入瓶中
C 未冷却至室温就打开了弹簧夹 D 实验过程中未用弹簧夹夹紧胶皮管
(5)若用其它物质代替红磷进行上述目的的实验,选择物质的依据是_____。
A 只与氧气反应,不与空气中其他物质反应 B 与氧气反应后,不生成新的气态物质
【答案】红磷+氧气![]() 五氧化二磷 ④①③② 烧杯中水倒吸回集气瓶,集气瓶内水面上升至刻度线1(或上升一个刻度) BD AB
五氧化二磷 ④①③② 烧杯中水倒吸回集气瓶,集气瓶内水面上升至刻度线1(或上升一个刻度) BD AB
【解析】
(1)红磷在空气中燃烧发出黄光,放出大量热,产生白烟,生成的白烟就是五氧化二磷的固体小颗粒,因此文字表达式为:红磷+氧气![]() 五氧化二磷。
五氧化二磷。
(2)红磷燃烧测定空气中氧气含量的实验,实验准确的前提是装置气密性好,红磷要过量,因此首先需要检查装置的气密性,即④,然后需要将弹簧夹关闭,使集气瓶形成密闭环境,故为操作①,再点燃红磷,迅速伸入集气瓶中,为操作③,最后待集气瓶冷却至室温后,重新打开弹簧夹,观察水进入的量,即为消耗的氧气量,故正确的顺序是:④①③②。
(3)最后待集气瓶冷却至室温后,重新打开弹簧夹,可观察到烧杯中水倒吸回集气瓶,集气瓶内水面上升至刻度线1,由此可说明氧气的含量。
(4)A、红磷量不足,会有部分氧气未消耗,会导致吸入的水体积较少,由此测定的氧气含量偏小,选项错误。
B、点燃红磷,缓慢伸入集气瓶,由于集气瓶瓶口位置的气体受热膨胀,逸出集气瓶,后盖紧瓶盖,导致瓶内气体减少,被倒吸的水的量变大,会导致测定的氧气含量偏高,选项正确。
C、未冷却至室温就打开弹簧夹,此时集气瓶内的剩余气体体积膨胀,被倒吸入的水体积减少,因此氧气含量偏低,选项错误。
D、实验过程中未用弹簧夹夹紧胶皮管,在红磷燃烧过程中,瓶内气体会受热膨胀,从导管口逸出,导致冷却至室温时被倒吸进入的水的体积偏大,因此氧气含量也偏大,选项正确。
故答案选BD。
(5)本实验的关键在于通过消耗氧气,压强减小,观察倒吸进入的水的量得出消耗的氧气量,因此燃烧物不能够消耗除氧气外的其他物质,并且燃烧不能产生新的气体,否则都会导致实验出现误差。故答案选AB。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为____。
(2)制取氢氧化铜的化学方程式为____。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu;Ⅱ.Cu2O;Ⅲ.①____。
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:②____。 |
②过滤、洗涤、干燥。 | 得红色固体 |
(进行实验)
(结论分析)
③据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想___也有相同的现象。
④为了进一步确定1.44g红色固体的成分,同学们将充分反应的固体过滤、洗涤、干燥后称重为1.24g,通过计算后确定猜想Ⅲ正确,请你计算出1.44g红色固体中Cu为____g、Cu2O为______g。