题目内容
现有40.6g氧化钙和碳酸钙的固体混合物,将其高温煅烧至碳酸钙完全分解,称得煅烧后剩余固体质量比原混合物减少15.4g,则原固体混合物中钙元素的质量为下列的( )
| A.14g | B.18g | C.16.24g | D.29g |
B
解析试题分析:煅烧后剩余固体即氧化钙的质量为:40.6g﹣15.4g="25.2g"
所有CaO中的钙元素的质量:25.2g×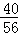 ×100%=18g
×100%=18g
所以原固体混合物中钙元素的质量为 18g;故选 B.
考点:化学计算

练习册系列答案
相关题目
将18g高锰酸钾加热,当产生1.6g氧气时,固体剩余物是 ( )
| A.KMnO4 MnO2 | B.K2MnO4 MnO2 |
| C.KMnO4 MnO2 K2MnO4 | D.KMnO4 K2MnO4 |
质量相同的下列金属,分别加入到足量的稀硫酸中充分反应,放出氢气最多的是 ( )
| A.Na | B.Al | C.Cu | D.Zn |
将ag铁和碳的混合物在氧气中充分灼烧,冷却,称量,发现剩余固体的质量仍为ag,该混合物中碳的质量分数为( )
| A.30.0% | B.22.2% | C.27.6% | D.10.3% |
锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,生成氢气0.2克,将反应后的溶液蒸发水分,则得固体硫酸锌、硫酸铝、硫酸镁的混合物的质量为
| A.13.6g | B.13.4 g | C.12 g | D.11g |
有一部分潮解和变质的苛性钠样品Wg,为了验证其变质的程度,将其加入98g质量分数为20%的稀硫酸中,充分反应后,再加入20g 20%的NaOH溶液恰好呈中性,则把溶液蒸干,可得到固体Na2SO4的质量为
| A.19.6g | B.14.2g | C.28.4g | D.30.4g |