题目内容
为了测定黄铜屑(由锌和铜形成的合金)样品组成.取了10g样品与足量稀硫酸93.7g恰好完全反应,质量减少了0.2g.(1)计算黄铜中铜的质量分数
(2)计算反应后溶液中溶质的质量分数.
【答案】分析:(1)利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,最后根据 ×100%求出黄铜中铜的质量分数.
×100%求出黄铜中铜的质量分数.
(2)反应后所得溶液中溶质的质量分数= ×100%,溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
×100%,溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
解答:解:(1)由题意可知,质量减少的就是氢气的质量.
设合金中锌的质量为x,硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
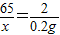
x=6.5g
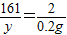
y=16.1g
铜的质量为10g-6.5g=3.5g
铜的质量分数=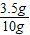 ×100%=35%
×100%=35%
答:黄铜样品中铜的质量分数为35%;
(2)反应后溶液的质量:6.5g+93.7g-0.2g=100g
完全反应后所得溶液的质量分数=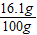 ×100%=16.1%
×100%=16.1%
答:反应后所得溶液的质量分数为16.1%.
点评:有关反应后所得溶液的计算是初中化学的一个重点,计算方法一般是:所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量.
 ×100%求出黄铜中铜的质量分数.
×100%求出黄铜中铜的质量分数.(2)反应后所得溶液中溶质的质量分数=
 ×100%,溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
×100%,溶质是硫酸锌,可根据氢气的质量求出,所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.解答:解:(1)由题意可知,质量减少的就是氢气的质量.
设合金中锌的质量为x,硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
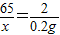
x=6.5g
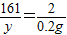
y=16.1g
铜的质量为10g-6.5g=3.5g
铜的质量分数=
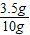 ×100%=35%
×100%=35%答:黄铜样品中铜的质量分数为35%;
(2)反应后溶液的质量:6.5g+93.7g-0.2g=100g
完全反应后所得溶液的质量分数=
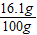 ×100%=16.1%
×100%=16.1%答:反应后所得溶液的质量分数为16.1%.
点评:有关反应后所得溶液的计算是初中化学的一个重点,计算方法一般是:所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量.

练习册系列答案
相关题目
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成.分四次取样品与稀硫酸反应,其实验数据记录如下表.
试计算:(1)黄铜中锌的质量分数;
(2)所用稀硫酸中溶质的质量分数.
| 1 | 2 | 3 | 4 | |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)所用稀硫酸中溶质的质量分数.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品的组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)经分析,在第2份样品测得的数据中, (填物质)完全反应了.
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.
| 样 品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)经分析,在第2份样品测得的数据中,
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.

某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)在四份样品所做实验中,稀硫酸有剩余的是 ;
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为 ;
(3)列式计算黄铜样品中铜的质量分数.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)在四份样品所做实验中,稀硫酸有剩余的是
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为
(3)列式计算黄铜样品中铜的质量分数.