题目内容
在老师的指导下,同学们进行了有趣的化学实验探究:
一、测定空气中氧气含量
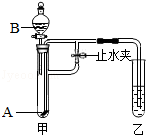
图1所示的是小亮同学用红磷在空气中燃烧的测定方法.过程是:
第1步:将集气瓶容积划分为五等份,并做好标记.
第2步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第3步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.请回答下列问题:

①第2步红磷燃烧时的现象 ,
化学反应表达式: 。
②实验完毕,若进入集气瓶中水的体积不到总容积的1/5,
你认为导致这一结果的原因可能是 。
A、集气瓶底部的水占了一部分体积
B、红磷过少
C、红磷没有燃烧完就急着打开了止水夹
③小博同学对实验进行反思后,提出了改进方法(如图2所示),小博在正式开始实验前,夹紧弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处.该操作的主要目的是 ,你认为改进后的优点是 。
二、小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验
的因素均忽略)
| 实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g | |
①上述实验应测量的“待测数据”是 。
②若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解。
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是 ,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:
将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃。
小淳同学这样做目的是 ,
【预期结论】氧化铜也能作氯酸钾的催化剂。
【评价设计】你认为小余设计实验③和实验②对比的目的是 ;写出实验②反应的表达式 。
三、有趣的改进实验
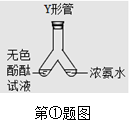
①小晴同学学了分子性质这节内容后,改进了书本上探究分子运动的实验。小晴同学找来废弃的医疗用品-----微型Y 形管,设计如图1所示实验,她进行该实验是为了探究 ,实验过程中能看到的现象是 ,小晴同学设计的实验优点是 。
②利用如图装置进行“硫燃烧”的实验:用气卿(能不断鼓入空气的装置)不断地向弯型具支试管中鼓入空气,同时用酒精灯给硫粉加热至燃烧,移去酒精灯,可观察到微弱的淡蓝色火焰;然后停止鼓入空气,再用酒精灯给高锰酸钾加热,使硫在纯氧中继续燃烧,观察到 火焰。
写出实验中硫磺燃烧的化学反应表达式: ,该实验装置的主要优点是在消除有害气体对环境污染的前提下有利于 .你推断烧杯中的氢氧化钠溶液的 作用是 。

一、①产生大量白烟, ②BC ③检验装置气密性 没有白烟进入空气,环保(不会有空气溢出,测量精确/直接读数,测量精确) 二、①时间(收集一定体积氧气所需时间)②小, ③验证氧化铜质量不变,验证氧化铜化学性质不变,比较氧化铜和二氧化锰的催化效果;
②BC ③检验装置气密性 没有白烟进入空气,环保(不会有空气溢出,测量精确/直接读数,测量精确) 二、①时间(收集一定体积氧气所需时间)②小, ③验证氧化铜质量不变,验证氧化铜化学性质不变,比较氧化铜和二氧化锰的催化效果;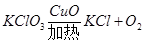 三、①分子不断运动;左侧酚酞变红;没有刺激性气味进入空气,环保(药品用量少);②蓝紫色;
三、①分子不断运动;左侧酚酞变红;没有刺激性气味进入空气,环保(药品用量少);②蓝紫色; ;对照硫在空气和氧气中燃烧(一套装置完成2个相关实验);吸收二氧化硫,
;对照硫在空气和氧气中燃烧(一套装置完成2个相关实验);吸收二氧化硫,
解析试题分析:红磷在空气中燃烧会发出黄光,放出热量,并生成大量白烟;在书写红磷在空气中燃烧的反应的表达式时,一定要找准找全反应物和生成物,并注明反应条件;集气瓶中的红磷过少,瓶内的氧气不能被完全消耗,会导致进入瓶内水的体积不足1/5,另外红磷没有燃烧完就急着打开止水夹,也会使瓶内空气中的氧气消耗不完,致使进入瓶内水的体积不足1/5;小博改进的实验最大的好处是在密封装置内进行实验,防止生成的五氧化二磷逸散到空气中,污染环境,在实验前,小博夹紧弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处是为了检查装置的气密性;要证明氧化铜对氯酸分解是否有催化作用及其催化效果,通过对比实验需要测出收集一定体积的氧气所需时间;如果加入氧化铜后氯酸钾分解产生相同体积的氧气所需要的时间少,说明氧化铜能加快氯酸钾的分解;要证明氧化铜是不是氯酸钾分解反应的催化剂,除了要证明其是否能改变氯酸钾的反应速度外,还要证明反应后它的质量和化学性质是否发生了改变;为了比较氧化铜和二氧化锰的催化效果,小博同学设计了实验②和实验③进行对照;小晴同学为了验证分子是不断运动的性质,设计了第①题的图示装置,在该实验中可以观察到左侧酚酞变红色,这样设计防止了氨气逸散到空气中,保护了环境;硫磺在纯氧气中燃烧发出蓝紫色火焰,放出热量,生成一种有刺激性气味的气体;在书写硫在氧气中燃烧的表达式时,一定要把反应物(硫和氧气)写到左边,把生成物二氧化硫写到右边,并注明反应条件点燃;实验②装置的改进优点是防止了二氧化硫向空气中逸散;为了吸收掉装置内的二氧化硫,所以把装置的尾气通入到了氢氧化钠溶液中。
考点:催化剂的探究,空气中氧气含量的测定,分子的性质实验,氧气的制取及性质实验。

某学习小组在探究“酸的化学性质”时,做了如图所示的A、B两个实验.分别向氢氧化钠和碳酸钠溶液中加入一定质量的稀硫酸,反应结束后,把废液倒入同一个废液缸中,观察到废液缸中产生少量气泡.请回答下列问题:
(1)试管A中的化学方程式是 ,在实验过程中并没有观察到该反应的明显现象,请你写出一种能观察到变化发生的方法
;
(2)通过分析废液缸中的现象,你认为B试管的废液中溶质成分是 (填化学式,下同);
(3)小组同学对废液缸中最终废液的成分进行探究,请你一起参与探究
【提出问题】最终废液中溶质是什么?
【查阅资料】硫酸钠溶液显中性
【假设猜想】猜想①:Na2SO4
猜想②:Na2SO4、Na2CO3
猜想③:
【实验探究】请你设计实验,确定哪个猜想是正确的.
| 实验步骤 | | 实验结论 |
| 取少量废液于试管中 滴加紫色石蕊试液 | | 猜想1正确 |
| | 猜想2正确 | |
| | 猜想3正确 |
A、B、C为初中常见物质,它们之间的转化关系如图(反应条件、部分反应物和生成物已略去).
请针对以下四种情况回答问题.
(1)若A、B、C均为氧化物,除氧元素外另一种元素均不相同,且三种物质常温下状态均不相同.A、B、C的化学式分别为 .
(2)若A、B、C均为含有相同金属元素的化合物.向这三种物质得溶液中分别滴加稀盐酸,现象如下.A的化学式为 ,B→C反应的化学方程式为 .
| | A中现象 | B中现象 | C中现象 |
| 滴加稀盐酸 | 无明显变化 | 有气泡出现 | 无明显变化 |
(3)若A、B、C三种物质的组成中均有两种相同元素,且两种相同元素的原子个数比均为1:1.A的化学式为 ,B→C反应的化学方程式为 .
(4)若A、B、C三种物质的组成中含有一种相同元素,且组成元素分别为一种、两种和三种.A、B、C的化学式分别为 (至少写出两组).
小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
| 序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
| ① | 2.0g | | 330℃ | 100mL | T1 |
| ② | 2.0g | CuO 0.5g | 330℃ | 100mL | T2 |
| ③ | 2.0g | MnO2 0.5g | 330℃ | 100mL | T3 |
| ④ | 2.0g | MnO2 g | 380℃ | 100mL | T4 |
若t1 t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的___________和________________不变。
你认为小雨设计实验③和实验②对比的目的是 。
实验④中MnO2的质量为 g,若t3>t4,则化学反应快慢与温度的关系是 。
(4)写出实验④所涉及的化学方程式 。
人教版新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
【实验结论】
(1)A中产生的气体是 ;
(2)实验II、III证明:氧化铁的质量和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
实验设计IV的目的是 ;
若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
查阅资料得知,CuO、CuSO4、、、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是 。

A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.酶是一种重要的生物催化剂,它属于糖类
E.用作催化剂的物质不可能是其他反应的反应物或生成物
请回忆你曾观察、学习过的一组实验。取四朵用石蕊溶液染成紫色的干燥的纸花,分别按下图进行实验。
请根据图示进行思考并回答下表中的问题:
| | (I) | (II) | (III) | (IV) |
| 现象 | 紫色纸花变红 | 紫色纸花不变色 | 紫色纸花不变色 | ______ ______ |
| 分析 | ①实验(III)验证了 : 实验(Ⅳ)验证了 ; ②通过实验(I)、(Ⅳ),可验证酸的一条化学性质是 : ③实验(Ⅳ)结束后,将纸花用酒精灯小心加热烘烤后纸花又变紫, 说明碳酸 ,并写出文字表达式 | |||
实验室有失去标签的下列化肥:碳酸氢铵、硫酸铵、磷矿粉、氯化钾.现要对这四种化肥进行鉴别.
(1)请填写下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| ①观察药品的颜色 | 有一瓶呈灰色 | 该化肥是 |
| ②打开三瓶颜色为白色的化肥的瓶盖,闻气味 | 有一瓶有强烈的刺激性气味 | 该化肥是 |
| ③取少许剩余的两种化肥,分别加入少量熟石灰,混合研磨,闻气味 | 有刺激性气味 | 该化肥是 (填化学式) |
| 无刺激性气味 | |
(3)反思:由实验②可知,该化肥要保存在 处;由实验③可以发现,在农业生产中, (“钾肥”、“磷肥”、“铵态氮肥”)不能与碱性肥料一起施用。