题目内容
对碳酸钙、碳酸氢铵、碱式碳酸铜三种碳酸盐的性质比较:
在1、2、3三试管中依次加入碳酸钙、碳酸氢铵、碱式碳酸铜各少量固体(各2份)。
第一份:在1、2、3三试管中各倒入少些水并振荡至充分溶解,用玻璃棒蘸取液体并与标准比色卡对照,可测定三种物质的pH 。实验时要多次使用玻璃棒,所以,每次测定后应对玻璃棒进行 处理。根据你的实验结果,可以得出上述三种碳酸盐水溶液的pH由大到小的顺序是(填试管编号):
试管 >试管 >试管 。![]() (1分)
(1分)
将1、2、3三试管置于烧杯内热水水浴。根据你的实验结果和学过的知识,可以得出
三种碳酸盐的热稳定性由强至弱的顺序是(填化学式):
> > 。(1分)
按盐的组成分类,碳酸钙、碳酸氢铵、碱式碳酸铜依次为正盐、酸式盐和碱式盐。初步推想,正盐、酸式盐和碱式盐的热稳定性由强至弱的顺序应该是:
> > 。(1分)
第二份:在1、2、3三试管中分别加入稀盐酸,都能观察到 ![]() 。
。
要鉴定该气体,你的操作方法是:
![]() 。
。
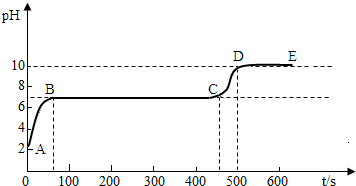
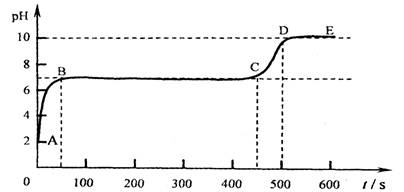
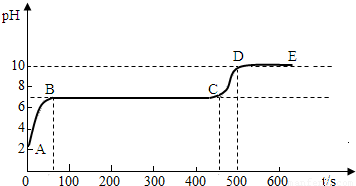
碳酸钙和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2。 此时取适量
反应后溶液,逐滴滴入碳酸钠溶液,并用![]() pH数字探测仪连续监测,得曲线如下
pH数字探测仪连续监测,得曲线如下
[ pH为纵坐标,时间s(秒)为横坐标]:

② 写出BC“平台”段化学方程式 ;
③ CD段上升的原因是: 。
第一份: 用蒸馏水冲洗并用滤纸擦干 试管 1 >试管 3 > 试管 2 。
碳酸钙> 碱式碳酸铜 >碳酸氢铵 ![]() 正盐> 碱式盐 > 酸式盐
正盐> 碱式盐 > 酸式盐
第二份: 大量气泡并发热 用玻璃棒蘸取澄清石灰水放试管口或试管内,变浑浊
(或:用带导管的单孔塞插入试管口并旋紧,将气体通入装有澄清石灰水的试管![]() 中变浑浊)
中变浑浊)
Na2CO3+CaCl2=2NaCl+CaCO3↓
碳酸钠溶液呈碱性,过量的碳酸钠使呈溶液的碱性增强

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案