题目内容
对碳酸钙、碳酸氢铵、碱式碳酸铜三种碳酸盐的性质比较:在1、2、3三试管中依次加入碳酸钙、碳酸氢铵、碱式碳酸铜各少量固体.
第一份:在1、2、3三试管中各倒入少些水并振荡至充分溶解,用玻璃棒蘸取液体并与标准比色卡对照,可测定三种物质的pH.实验时要多次使用玻璃棒,所以,每次测定后应对玻璃棒进行 处理.根据你的实验结果,可以得出上述三种碳酸盐水溶液的pH由大到小的顺序是(填试管编号):试管 >试管 >试管 .
将1、2、3三试管置于烧杯内热水水浴.根据你的实验结果和学过的知识,可以得出
三种碳酸盐的热稳定性由强至弱的顺序是(填化学式): > > .
按盐的组成分类,碳酸钙、碳酸氢铵、碱式碳酸铜依次为正盐、酸式盐和碱式盐.初步推想,正盐、酸式盐和碱式盐的热稳定性由强至弱的顺序应该是: > > .
第二份:在1、2、3三试管中分别加入稀盐酸,都能观察到 .要鉴定该气体,你的操作方法是: .
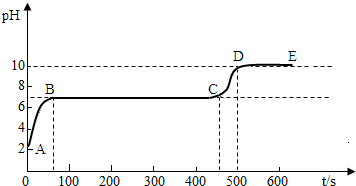
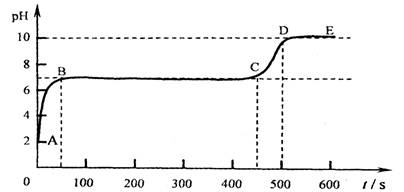
碳酸钙和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2. 此时取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
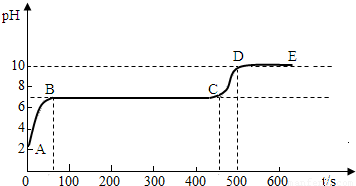
2写出BC“平台”段化学方程式 ;3CD段上升的原因是: .
【答案】分析:第一份:在用玻璃棒蘸取液体测定三种物质的pH时,要保证玻璃棒的干燥和洁净,而在这三种碳酸盐中pH值最大的为碳酸钙,其次为碱式碳酸铜,碱性最弱的为碳酸氢铵,碳酸钙要高温才能分解,所以稳定性最强 碱式碳酸铜要加热能分解 碳酸氢铵在常温下就能分解,可以据此解答.
第二份:这三种盐都可以和盐酸反应生成二氧化碳气体,检验二氧化碳常用澄清石灰水,残留液pH等于2,可以知道溶液为酸性,所以加入碳酸钠溶液后要发生反应而使溶液的pH值增大,直至把其中的氢离子反应完全后,开始产生沉淀,即BC段发生的反应为碳酸钠和氯化钙的反应,而在CD段由于氯化钙被反应完全,而碳酸钠的碱性较强,所以溶液的pH值要增大,可以据此解答.
解答:解:第一份:在用玻璃棒蘸取液体测定三种物质的pH时,要保证玻璃棒的干燥和洁净,而在这三种碳酸盐中pH值最大的为碳酸钙,其次为碱式碳酸铜,碱性最弱的为碳酸氢铵,即三支试管的pH大小顺序为:试管1>试管3>试管2;碳酸钙要高温才能分解,所以稳定性最强 碱式碳酸铜要加热能分解 碳酸氢铵在常温下就能分解,所以它们你的热稳定性顺序为:碳酸钙>碱式碳酸铜>碳酸氢铵,同时可以得出正盐、酸式盐和碱式盐的热稳定性由强至弱的顺序为:正盐>碱式盐>酸式盐.
第二份:这三种盐都可以和盐酸反应生成二氧化碳气体,检验二氧化碳常用澄清石灰水,具体的操作步骤及现象为:用玻璃棒蘸取澄清石灰水放试管口或试管内,变浑浊;残留液pH等于2,可以知道溶液为酸性,所以加入碳酸钠溶液后要发生反应而使溶液的pH值增大,直至把其中的氢离子反应完全后,开始产生沉淀,即BC段发生的反应为碳酸钠和氯化钙的反应,其反应的化学方程式为:Na2CO3+CaCl2═2NaCl+CaCO3↓.而在CD段由于氯化钙被反应完全,而碳酸钠的碱性较强,所以溶液的pH值要增大.
故答案为:第一份:用蒸馏水冲洗并用滤纸擦干;1>3>2.
碳酸钙>碱式碳酸铜>碳酸氢铵;正盐>碱式盐>酸式盐;
第二份:大量气泡并发热;用玻璃棒蘸取澄清石灰水放试管口或试管内,变浑浊(或用带导管的单孔塞插入试管口并旋紧,将气体通入装有澄清石灰水的试管中变浑浊);Na2CO3+CaCl2═2NaCl+CaCO3↓;碳酸钠溶液呈碱性,过量的碳酸钠使呈溶液的碱性增强.
点评:要想解答好这类题目,首先,要理解和熟记常见的碳酸盐的化学性质、用途、反应现象和化学方程式,以及与之相关的知识.然后,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
第二份:这三种盐都可以和盐酸反应生成二氧化碳气体,检验二氧化碳常用澄清石灰水,残留液pH等于2,可以知道溶液为酸性,所以加入碳酸钠溶液后要发生反应而使溶液的pH值增大,直至把其中的氢离子反应完全后,开始产生沉淀,即BC段发生的反应为碳酸钠和氯化钙的反应,而在CD段由于氯化钙被反应完全,而碳酸钠的碱性较强,所以溶液的pH值要增大,可以据此解答.
解答:解:第一份:在用玻璃棒蘸取液体测定三种物质的pH时,要保证玻璃棒的干燥和洁净,而在这三种碳酸盐中pH值最大的为碳酸钙,其次为碱式碳酸铜,碱性最弱的为碳酸氢铵,即三支试管的pH大小顺序为:试管1>试管3>试管2;碳酸钙要高温才能分解,所以稳定性最强 碱式碳酸铜要加热能分解 碳酸氢铵在常温下就能分解,所以它们你的热稳定性顺序为:碳酸钙>碱式碳酸铜>碳酸氢铵,同时可以得出正盐、酸式盐和碱式盐的热稳定性由强至弱的顺序为:正盐>碱式盐>酸式盐.
第二份:这三种盐都可以和盐酸反应生成二氧化碳气体,检验二氧化碳常用澄清石灰水,具体的操作步骤及现象为:用玻璃棒蘸取澄清石灰水放试管口或试管内,变浑浊;残留液pH等于2,可以知道溶液为酸性,所以加入碳酸钠溶液后要发生反应而使溶液的pH值增大,直至把其中的氢离子反应完全后,开始产生沉淀,即BC段发生的反应为碳酸钠和氯化钙的反应,其反应的化学方程式为:Na2CO3+CaCl2═2NaCl+CaCO3↓.而在CD段由于氯化钙被反应完全,而碳酸钠的碱性较强,所以溶液的pH值要增大.
故答案为:第一份:用蒸馏水冲洗并用滤纸擦干;1>3>2.
碳酸钙>碱式碳酸铜>碳酸氢铵;正盐>碱式盐>酸式盐;
第二份:大量气泡并发热;用玻璃棒蘸取澄清石灰水放试管口或试管内,变浑浊(或用带导管的单孔塞插入试管口并旋紧,将气体通入装有澄清石灰水的试管中变浑浊);Na2CO3+CaCl2═2NaCl+CaCO3↓;碳酸钠溶液呈碱性,过量的碳酸钠使呈溶液的碱性增强.
点评:要想解答好这类题目,首先,要理解和熟记常见的碳酸盐的化学性质、用途、反应现象和化学方程式,以及与之相关的知识.然后,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目