题目内容
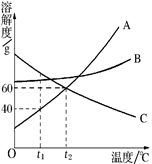
(7分)下表为氯化钠、硝酸钾和氢氧化钙在不同温度下的溶解度。
(1)从上表数据能获得的一条信息是 。
(2)20℃时分别往盛有100g水的烧杯中加入上述三种物质各35g,充分溶解后如图所示,则乙烧杯中的溶质是 。要使丙烧杯中的固体完全溶解,可采取的一种措施是 。

(3)在60℃时将100g水配成KNO3的饱和溶液,再将其降温至20℃所得溶液的质量为 。
(4)我们常用熟石灰中和污水中含有的硫酸,现有100 t含硫酸0.49%的废水,该废水含有硫酸的质量
是 t,完全处理这些废水需要氢氧化钙的质量是 t。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度 / g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.187 | 0.178 | 0.165 | 0.153 | 0.141 | 0.129 | 0.116 | |
(2)20℃时分别往盛有100g水的烧杯中加入上述三种物质各35g,充分溶解后如图所示,则乙烧杯中的溶质是 。要使丙烧杯中的固体完全溶解,可采取的一种措施是 。

(3)在60℃时将100g水配成KNO3的饱和溶液,再将其降温至20℃所得溶液的质量为 。
(4)我们常用熟石灰中和污水中含有的硫酸,现有100 t含硫酸0.49%的废水,该废水含有硫酸的质量
是 t,完全处理这些废水需要氢氧化钙的质量是 t。
(1)NaCl的溶解度随温度的升高变化不大 (2)NaCl 加水或升高温度
(3)131.6g (4)0.49 0.37
(3)131.6g (4)0.49 0.37
试题分析:(1)从上表数据能获得的一条信息是:NaCl的溶解度随温度的升高变化不大或KNO3的溶解度随温度的升高变化较大或Ca(OH)2的溶解度随温度的升高而降低等
(2)根据20℃时三种物质的溶解度,NaCl >KNO3>Ca(OH)2,所以可判断则乙烧杯中的溶质是NaCl,甲烧杯中的溶质是Ca(OH)2,丙烧杯中的溶质是KNO3,所以结合丙的溶解度随温度变化的趋势,要使丙烧杯中的固体完全溶解,可采取的一种措施是:加水或升高温度
(3)在60℃时将100g水配成KNO3的饱和溶液,再将其降温至20℃,所得溶液为20℃是的饱和溶液,而此时溶解度为31.6g,所以溶液的质量为100g+31.6g=131.6g
(4)根据溶质质量分数的表达式,可得溶质质量=100t×0.49%=0.49t,再根据化学方程式:Ca(OH)2+H2SO4==CaSO4+2H2O中Ca(OH)2与H2SO4的质量关系,不难求出需要氢氧化钙的质量是0.37t

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目