题目内容
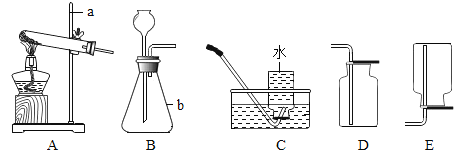
【题目】下列实验操作正确的是
A. 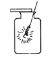 铁丝在氧气中燃烧 B.
铁丝在氧气中燃烧 B.  加热高锰酸钾
加热高锰酸钾
C. 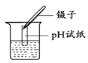 测定溶液pH D.
测定溶液pH D. 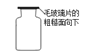 暂时储存氧气
暂时储存氧气
【答案】D
【解析】A、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中集气瓶的底部没有放少量的水或铺一层细沙,图中操作错误;B、加热高锰酸钾制氧气时,试管口应略向下倾斜,以防止冷凝水的倒流,图中操作错误;C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染待测液,图中操作错误;D、氧气的密度比空气大,放置集满氧气的集气瓶时,瓶口应向上放置,且毛玻璃粗糙面朝下,图中操作正确。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】在高温条件下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小莉很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
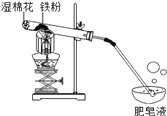
(1)试管尾部放一团湿棉花的目的是_____________________。
(2)探究生成的气体是什么?
用燃着的木条靠近飘到空中的肥皂泡,
有爆鸣声。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
【查阅资料】(1)常见铁的氧化物的物理性质如下表:
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
(2)稀盐酸(或稀硫酸)与铁反应产生气体,与铁的氧化物反应没有气体产生。
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是_____________。
【实验探究】根据猜想与假设,设计实验方案加以检验。
实验操作 | 实验现象 | 实验结论 |
____________________ | _________ | 剩余固体是Fe3O4 |
【实验结论】铁和水蒸气反应的化学方程式为____________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是___________________。
【题目】合成氨是人类科学技术上的一项重大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:
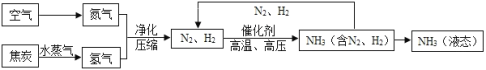
(1)流程中生成的氨(NH3),在农业上是合成_________(填“氮肥”“磷肥”或“钾肥”)的原料。
(2)制取氢气的反应过程为:C + H2O![]() CO + H2,其中发生还原反应的物质是_____________。
CO + H2,其中发生还原反应的物质是_____________。
(3)写出N2、H2反应生成NH3的化学方程式_________________________________。
(4)该流程中可循环使用的物质是___________________。
(5)将沸点不同的气体分离开来,常采用液化分离法。下表是各物质的沸点。
物质 | H2 | N2 | O2 | NH3 |
沸点 | – 252℃ | – 195.8℃ | – 183℃ | – 33.35℃ |
如控制温度t在![]() 时,可将空气中N2与O2分离。要将产物NH3与N2、H2分离开来,应将温度控制在_________(填序号)。
时,可将空气中N2与O2分离。要将产物NH3与N2、H2分离开来,应将温度控制在_________(填序号)。
A.![]() B.
B.![]() C.
C.![]()