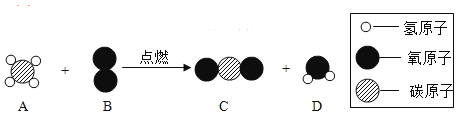
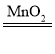题目内容
【题目】人类的生活和生产离不开金属,我们要合理的利用开发金属及其矿物资源。
(1)请你写出赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式为_____
(2)如图是镓在元素周期表中的部分信息,则镓的相对原子质量是_____
![]()
(3)金属资源的储量有限,而且不能再生,因此要加强废旧金属的回收。回收废旧手机中的金属材料的意义是_____(答一点即可)
【答案】Fe2O3+3CO![]() 2Fe+3CO2 69.72 节约金属资源
2Fe+3CO2 69.72 节约金属资源
【解析】
(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用 CO 的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为 69.72;
(3)手机中的一些重金属随意抛弃会污染土壤和水资源,还会造成金属资源的浪费,而金属资源是不可再生的资源;

【题目】兴趣小组的同学准备进行常见酸、碱盐的性质实验时,发现实验台上摆放的药品中,有一瓶装有溶液的试剂瓶未盖瓶盖且标签破损(如图所示),于是决定对这瓶溶液进行实验探究。
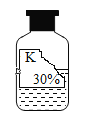
[提出问题]这瓶试剂可能是什么溶液呢?
[查阅资料]
I.初中化学常见的含钾化合物有KCl、KOH、K2CO3、KHCO3。
II. K2CO3和KHCO3溶液都呈碱性。
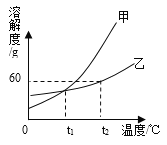
III.20℃时,测得四种物质的溶解度数据如下:
物质 | KCl | KOH | K2CO3 | KHCO3 |
溶解度/g | 34 | 112 | 111 | 33.7 |
[初步探究]小山根据试剂瓶标注的溶质质量分数30%和上表中的溶解度数据判断,这瓶试剂不可能是__________,理由是_________________。
[做出猜想]试剂瓶中溶液的溶质可能是①KOH;②K2CO3;③…….
[设计实验]小西取待测液于试管中滴加氢氧化钙溶液,观察到有白色沉淀产生,由此他认为猜想②正确。
[反思评价]小强不完全认同小西的结论,理由是______________。他另取样品,进行了如下实验:
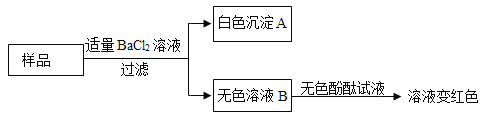
生成白色沉淀A的化学方程式为____________;通过实验可以判断样品中含有的溶质有_____________。
[得出结论]原瓶中的溶质是___________,且已变质。