题目内容
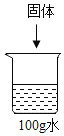
【题目】依据下列![]() 时的实验和数据回答。已知
时的实验和数据回答。已知![]() 时,NaCl和NaNO3的溶解度分别为36g和88g。
时,NaCl和NaNO3的溶解度分别为36g和88g。
| 序号 |
|
|
|
|
|
固体种类 | NaCl | NaCl | NaNO3 | NaNO3 | NaNO3 | |
固体的质量 | 30 | 60 | 30 | 60 | 90 | |
水的质量 | 100 | 100 | 100 | 100 | 100 |
下列关于![]() 所得溶液的说法不正确的是
所得溶液的说法不正确的是![]()
![]()
A. 溶质质量:![]()
B. 溶液质量:![]()
C. 溶质质量分数:![]()
D. ![]() 中溶质与溶剂的质量比为9:10
中溶质与溶剂的质量比为9:10
【答案】D
【解析】
A、30g氯化钠能够完全溶解在100g水中,溶质质量是30g,60g氯化钠能够溶解36g在100g水中,溶质质量是36g,选项正确;
B、100g水中溶解36g氯化钠达到饱和,溶液质量是136g,60g硝酸钠能够完全溶解在100g水中,溶液质量是160g,选项正确;
C、两种溶液都是不饱和溶液,溶质质量相等,溶液质量相等,因此溶质质量分数相等,选项正确;
D、![]() 中溶质与溶剂的质量比为88g:
中溶质与溶剂的质量比为88g:![]() :10,选项错误,故选D。
:10,选项错误,故选D。

练习册系列答案
相关题目