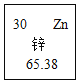
题目内容
【题目】(1)说出下面符号中“2”的意义
①SO42-中_____; ②3H2O_____; ③2Ba_____;④![]() _____;
_____;
(2)根据文字叙述书写方程式
①实验室用氯酸钾和二氧化锰的混合物制氧气_____;
②红磷在空气中燃烧_____;
③氢氧化亚铁与氧气和水反应生成氢氧化铁_____。
【答案】一个硫酸根离子带两个单位负电荷 一个水分子中含有两个氢原子 2个钡原子 氧化镁中镁元素的化合价为+2价 2KClO3![]() 2KCl+3O2↑ 4P+5O2
2KCl+3O2↑ 4P+5O2![]() 2P2O5 4Fe(OH)2+2H2O+O2=4Fe(OH)3
2P2O5 4Fe(OH)2+2H2O+O2=4Fe(OH)3
【解析】
(1)①SO42-中2的意义是:一个硫酸根离子带两个单位负电荷;故填:一个硫酸根离子带两个单位负电荷;
②3H2O中的2表示一个水分子中含有两个氢原子,故填:一个水分子中含有两个氢原子;
③2Ba中的2表示2个钡原子,故填:2个钡原子;
④![]() 中的2表示氧化镁中镁元素的化合价为+2价,故填:氧化镁中镁元素的化合价为+2价;
中的2表示氧化镁中镁元素的化合价为+2价,故填:氧化镁中镁元素的化合价为+2价;
(2)①氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;故填:2KClO3
2KCl+3O2↑;故填:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
②红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5;故填:4P+5O2
2P2O5;故填:4P+5O2![]() 2P2O5;
2P2O5;
③氢氧化亚铁与氧气、水发生反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;故填:4Fe(OH)2+2H2O+O2=4Fe(OH)3。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】某化学兴趣小组对书本知识进行的一系列深入探究学习。
探究一 分子运动及影响分子运动速率的因素。
小明采用下图甲A-D装置进行实验,请你完成分析与讨论
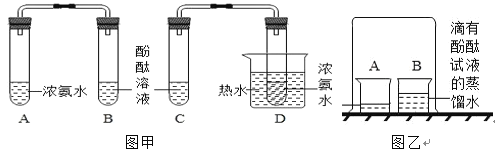
[分析与讨论]
(1)该实验现象是C试管比B试管中的酚酞______________(填“先”或“后”)变红。
(2)通过该现象可得出的结论:分子在不停地的运动,其运动速率与___________有关。
(3)该实验(图甲)与课本实验(图乙)相比,优点是__________(写一条即可)。
探究二实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题,小张设计下列实验方案并完成了对该命题的实验证明。
实验一、操作:将氯酸钾加热,在加热过程中伸入带火星木条
现象:氯酸钾直到熔化时,带火星木条才复燃
结论:氯酸钾受热会分解产生氧气,但是时间长,温度较高
实验二、操作:加热二氧化锰,伸入带火星木条
现象:木条__________________ 。
结论:加热二氧化锰不产生氧气
实验三、操作:__________________ 。
现象:木条迅速复燃
结论:二氧化锰能加快氯酸钾的分解,该反应符号表达式为_________________。
总结:二氧化锰是氯酸钾受热分解的催化剂
(1)请你帮小张同学填写实验方案中未填完的空格。
(2)小英同学认为仅由上述实验还不能完全得出方案内的“总结”,他补充了二个方面的探究实验,最终完成了对“命题”的实验验证。
第一个方面的探究实验,其目的是证明二氧化锰在反应前后质量不变。
第二个方面的探究实验,其目的是____________________。
(3)用氯酸钾和二氧化锰制氧气的过程中,小英同学用如图表示相关物质的质量(m)与消耗的氯酸钾质量(M)变化关系,其中正确的是__________。
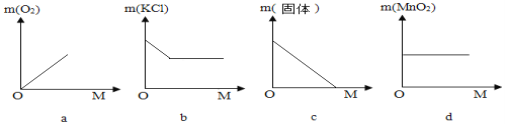
探究三 认识化学式丰富的内涵
下表是几种常见的酯类物质,请你一起完成(1)、(2)、(3)、(4)题的填空
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
(1)甲酸甲酯的相对分子质量为___________。
(2)据表推测X的化学式________________。
(3)实验测得由甲酸甲酯(C2H4O2)、甲酸乙酯(C3H6O2)组成的混合物中氢元素的质量分数为a%,试求:
①a%的数值范围__________(精确到0.1%)。
②该混合物中氧元素的质量分数为__________。