题目内容
【题目】在探究金属的活动性顺序时,某同学讲一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,实验流程如图所示,请分析回答:
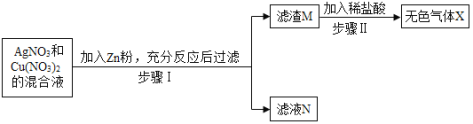
⑴步骤Ⅰ的操作名称是____________
⑵步骤Ⅱ中生成的无色气体X是___________;滤液N中的溶质是___________。
【答案】过滤 氢气 硝酸锌
【解析】
将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,锌的金属活动性比银、铜强,锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银溶液反应完,若还有锌,锌与硝酸铜溶液反应生成硝酸铜溶液和铜,滤渣M与稀盐酸反应生成无色气体,说明滤渣中含有能与稀盐酸反应的金属,该金属应为锌,说明锌是过量的,生成的气体X是氢气;而滤液N是硝酸锌溶液。
由分析可知:(1)分离固体和液体的操作为过滤,故步骤Ⅰ的操作名称是过滤;
(2)锌与稀盐酸反应生成的气体为氢气;滤液N是硝酸锌溶液,溶质是硝酸锌。

练习册系列答案
相关题目
【题目】将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
下列判断正确的是( )
A. 表中m的值无法确定
B. X可能是该反应的催化剂
C. 增加氧气的量可以减少X的生成
D. 物质X一定含有碳元素,可能含有氢元素