题目内容
【题目】如图是甲、乙固体的溶解度曲线。下列说法正确的是( )
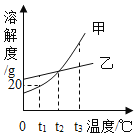
A.图中 P 点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时 20%的甲溶液配制 10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,此时二者溶液的质量仍然相等
【答案】C
【解析】
A、P点在甲的溶解度曲线下方,表示溶液是t3℃时甲的不饱和溶液,选项错误;
B、由图可知,t1℃时甲的溶解度为20g,此时甲的饱和溶液的溶质质量分数小于20%选项错误;
C、甲、乙的溶解度均随温度升高而增大,且甲的溶解度受温度影响较大,所以若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲,选项正确;
D、分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,由于甲的溶解度受温度影响较大,则甲析出的晶体会多一点,所以此时二者溶液的质量关系为:甲<乙,选项错误,故选C。

 名校课堂系列答案
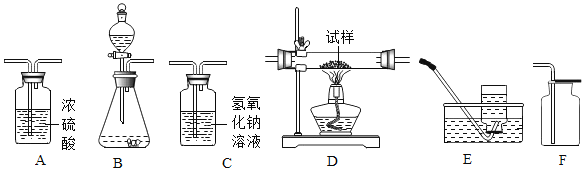
名校课堂系列答案【题目】(1)同学们用下图所示仪器和装置探究制取气体的方法,请回答下列问题:
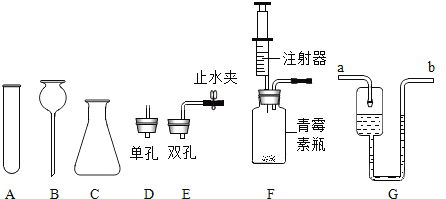
①图中仪器 B 的名称为_____。
②装配 KClO3 制备O2 的发生装置,上图中还缺少的玻璃仪器是__________(写名称),该反应的化学方程式是______________。
③图中的微型装置 F 可用于实验室制备 H2,反应化学方程式为___________。该装置在操作上的优点是_______。G 是医用输液观察滴液快慢的滴壶,若用它作微型的 O2 干燥装置,则气体应从______(填选“a”或“b”)进入,滴壶中装的试剂是_____。
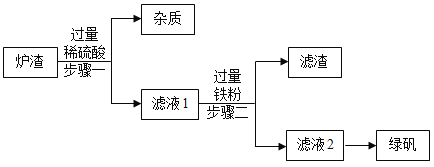
(2)实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
(查阅资料)
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是 CaO 和NaOH 的固体混合物,NaOH 与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
(发现问题)
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成.
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:探究一:碱式碳酸铜受热分解生成的黑色固体成分.
(猜想与假设)该黑色固体可能是①碳粉;②_____;③碳和氧化铜的混合物。
(设计方案)请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
__________________________________ | 猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成 CO2 和H2O.
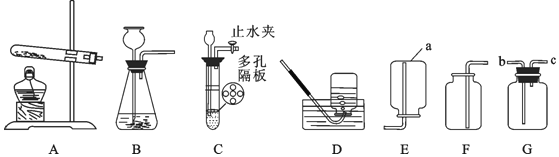
(进行实验)选择如下图所示装置进行验证
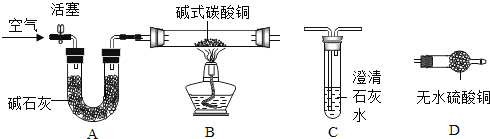
步骤一:连接A 和 B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置 A→B→_____→_____(填“C”,“D”);步骤三:点燃酒精灯,观察到明显现象后,停止加热。
(解释与结论)
①当观察到_____,说明碱式碳酸铜受热分解生成了 CO2 和H2O,写出装置 C 中反应的化学方程式_________;
②写出 Cu2(OH)2CO3 受热分解的化学方程式________。
(反思与评价)
上述装置中A 的作用是_________。