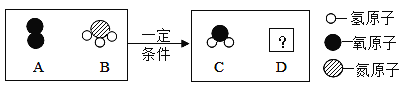
题目内容
【题目】九年级化学课本上有一道习题: “热水瓶胆内壁常附着一层水垢(主要成分是碳酸钙和氢氧化镁) ……”化学学习小组的同学欲对水垢的来源、成分等开展进一步的探究活动,请你参与:实验探究一区别软水和硬水:小组同学分别取等体积的雨水和日常用水,分别滴入相同滴数的_____,振荡,判断该地区日常用水属于硬水的现象是_____。
实验探究二 硬水为什么会产生水垢?
[查阅资料]
(1)自然界的碳酸钙在有水和二氧化碳的侵蚀下,会生成可溶于水的碳酸氢钙,硬水中含有大量的自由移动的Ca2+、Mg2+、HCO3-离子。加热后形成难溶物积聚在容器底部,形成水垢。
(2)加热碳酸氢镁会分解生成碳酸镁,但是长时间煮沸,碳酸镁会与水发生反应生成更难溶于水的氢氧化镁。
[猜想与假设j
水垢中可能含有CaCO3、 Mg(OH)2, 还可能含有_____(填化学式)。
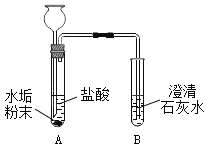
[实验验证]取水垢研成粉末,各取少量于下面的A、C、D三支试管中进行如下实验:
步骤 | 方法 | 现象 | 初步结论 |
1 |
| _____ | 水垢中含有碳酸盐 |
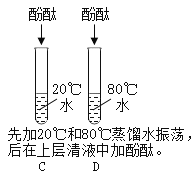
2 |
| C试管无现象,D试管液体变红,冷却后又褪为无色 | 水垢中含有_____ |
写出A试管发生的一个化学方程式:_____。
附加:(1)将水垢溶解在100g不同温度的蒸馏水中,达到饱和,利用传感器测定出溶液中的某几种离子的浓度(单位体积的溶液中所含离子的数目)与温度的变化关系如下图:
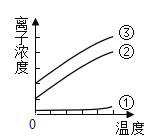
推测表示曲线③的离子符号是_____。
(2)D试管上层液体加酚酞试液,先变红后又褪色的原因,除了与氢氧化镁的溶解度有关外,还有可能的原因是_____。
(3)我省南部山区的石灰岩岩洞内发生的变化,就与碳酸钙和碳酸氢钙的相互转变有关,“世界是物质的,物质是在不断变化的”,请你再举一种物质, 简要说明它在自然界的循环_____。
【答案】肥皂水 泡沫少,有浮渣 MgCO3 A试管中产生气泡;B试管中澄清石灰水变浑浊 Mg(OH)2 ![]() OH- 氢氧化镁与空气中的二氧化碳反应 植物光合作用吸收二氧化碳产生氧气,而动植物的呼吸和燃料燃烧消耗氧气产生二氧化碳(答案合理即可)
OH- 氢氧化镁与空气中的二氧化碳反应 植物光合作用吸收二氧化碳产生氧气,而动植物的呼吸和燃料燃烧消耗氧气产生二氧化碳(答案合理即可)
【解析】
请你参与:实验探究一区别软水和硬水:分别取等体积的雨水和日常用水,分别滴入相同滴数的肥皂水,振荡,判断该地区日常用水属于硬水的现象是:泡沫少、易起浮渣;
猜想与假设:由资料可知,水垢中可能含有CaCO3、 Mg(OH)2, 还可能含有:MgCO3;
实验验证:1、结论为水垢中含有碳酸盐,碳酸盐能与稀盐酸反应生成二氧化碳气体,二氧化碳能使澄清石灰水变浑浊,故实验现象为:A试管中产生气泡;B试管中澄清石灰水变浑浊;
2、向两只试管中加入少量水垢,向C试管中加入20℃蒸馏水,振荡,向D试管中加入80℃蒸馏水,振荡,后在上层清液中滴加酚酞,实验现象为:C试管无现象,D试管液体变红,冷却后又褪为无色,说明水垢中含有氢氧化镁,因为氢氧化镁属于难溶性物质,常温下溶解度很小,温度升高,会有一部分氢氧化镁溶于水,氢氧化镁显碱性,能使无色酚酞变红,温度降低,氢氧化镁的溶解度变小,又褪为无色;
A试管中碳酸钙可与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:![]() ;
;
附加:(1)根据资料,加热碳酸氢镁会分解生成碳酸镁,但是长时间煮沸,碳酸镁会与水发生反应生成氢氧化镁,故表示曲线③的离子符号是OH-;
(2)D试管上层液体加酚酞试液,先变红后又褪色的原因,除了与氢氧化镁的溶解度有关外,还有可能的原因是:氢氧化镁与空气中的二氧化碳反应生成了碳酸镁;
(3)如植物光合作用吸收二氧化碳产生氧气,而动植物的呼吸和燃料燃烧消耗氧气产生二氧化碳等。

 同步奥数系列答案
同步奥数系列答案【题目】根据下表中氯化钠和碳酸钠在不同温度时的溶解度,判断下列说法不正确的是
温度/°C | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
A.氯化钠的溶解度曲线和碳酸钠的溶解度曲线交点温度在20℃~30℃之间
B.20℃时,在50g的水中加入12.2 g碳酸钠,充分搅拌后得到的是饱和溶液
C.20℃时,无法配制溶质质量分数超过26.5%的氯化钠溶液
D.氯化钠中混有少量碳酸钠,可以采用降温结晶的方法除去碳酸钠
【题目】如图所示,将少量液体X加入烧瓶中,观察到气球逐渐膨胀。下表中液体X和固体Y的组合,符合题意的是( )
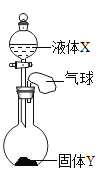
① | ② | ③ | ④ | |
| 过氧化氢溶液 | 水 | 水 | 水 |
| 二氧化锰 | 氯化钠 | 氢氧化钠 | 硝酸铵 |
A. ①②B. ①③C. ①③④D. ②③④
【题目】同学们对市场上烧烤花蛤用的“锡纸”产生了浓厚兴趣。查阅资料获知:市售锡纸也称作铝箔、铝箔锡纸等。那么“锡纸”中的金属是什么呢?
![]()
(猜想与假设)同学们结合金属的颜色、活动性、价格等因素。猜想:可能是锡、铝、镁、铁、中的一种。
(查阅资料)金属锌似晶体状,室温下,锌较硬且相当脆;氧化铝的熔点2054℃;
(初步探究)同学们结合金属的主要的物理和化学特性设计了如下实验:
序号 | 实验方案 | 现象 | 结论 |
1 | _____ | 无明显现象 | 金属不可能是铁 |
2 | 用坩埚钳夹取打磨后的“锡纸”条,放在酒精灯上点燃。 | “锡纸”条熔化但没有滴落,也没燃烧。 | 金属不可能是_____ |
(深入探究)同学们对于“锡纸”到底是什么金属,进行了深入的实验探究。
(1)第一组同学将“锡纸”条卷成和铁钉一样粗细,先在20%的盐酸中浸泡至产生较多气泡,再取蒸馏水清洗,然后浸在蒸馏水中备用。浸泡在盐酸中目的是_____。
(2)将打磨后的铁钉和备用的“锡纸”条分别放入到装有5mL 15% 的稀盐酸中(如图所示)。观察到“锡纸”条表面产生的气泡速率比铁钉快。
(实验结论)制作“锡纸”的金属是_____。写出“锡纸”条与稀盐酸反应的化学方程式:_____。
(交流与反思)
(3)“锡纸”在酒精灯上加热,“锡纸”熔化但没有滴落的原因是:_____。
(4)第二组同学,将备用的“锡纸”条放入到装有硫酸锌溶液的试管中。一段时间后,未观察到明显现象。同学们讨论分析可能的原因是:①反应速率较慢,生成物太少;②_____。
(5)同学们在老师的帮助下,将3克烘干的备用“锡纸”片放入装有硫酸锌溶液的试管中,5分钟后,取出“锡纸”片,洗涤、烘干、称量。反应后金属质量范围是_____。