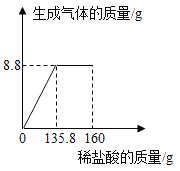
题目内容
【题目】下表是NaCl、KNO3在不同温度时的溶解度。
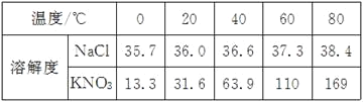
(1)若要比较KNO3与NaCl在水中的溶解能力,需要控制的变量是水的质量和________。
(2)20℃时,各取NaCl、KNO3固体3.5g分别加入10g水中,充分溶解后达到饱和状态的是________溶液。
(3)若将上表数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是________(填序号)。
A 0 ℃~20 ℃ B 20 ℃~40 ℃
C 40 ℃~60 ℃ D 60 ℃~80 ℃
【答案】温度 硝酸钾 B
【解析】
(1)若要比较KNO3与NaCl在水中的溶解能力,就需要比较二者在相同质量的水中,在相同的温度下哪种物质最多溶解的质量。所以需要控制的变量是水的质量和温度。
(2)根据表格中的数据可知:在20℃时,NaCl和KNO3的溶解度分别为36g和31.6g。所以在20℃时,在10g水中最多可溶解氯化钠3.6g;溶解硝酸钾3.16g。所以当二者均加入固体3.5g后,氯化钠还可再溶解,得到的是不饱和溶液;硝酸钾无法完全溶解,得到的是饱和溶液。
(3)在溶解度曲线图中,两物质的溶解曲线上的交点表示二者在相对应的温度下溶解度相等。根据上表数据可知二者的溶解度在温度为20℃~40℃之间时可能相等。所以应选B项。

【题目】化学兴趣小组的同学按图示装置及步骤验证氢氧化钠的化学性质。
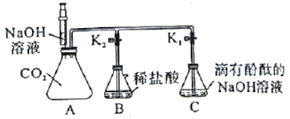
(实验步骤)
I.将注射器内的液体注入A中的锥形瓶。
II.打开K1,观察到C中部分红色溶液沿导管倒吸入A,片刻后回流停止。
III.打开K2,观察到B中溶液倒吸入A、C中,液面稳定后观察到A中溶液仍为红色,C中溶液变为无色。
同学们对相关问题分组展开如下探究。
探究环节 | 甲组的探究 | 乙组的探究 |
[提出问题] | A中使酚酞变为红色的物质是什么? | C中溶液为什么变成无色? |
[做出猜想] | 猜想一:Na2CO3 猜想二:Na2CO3和NaOH | 猜想一:实验过程中酚酞变质了 猜想二:溶液中的NaOH反应完了 |
[实验验证] | 小鹏取少量A中溶液于试管中,向其中滴加过量BaCl2溶液,若观察到______,证明猜想二成立。小丽认为用Ba(OH)2溶液也可证明猜想二成立,小鹏认为小丽的方案不合理,理由是_______。 | (1)取少量C中溶液于试管中,向其中滴加NaOH溶液.溶液又变为红色,证明猜想一不成立。 (2)用pH试纸测定C中溶液的酸碱度,若pH___7,证明猜想二成立。 |
(反思交流)(1)甲、乙两组同学的实验证明了NaOH能与稀盐酸、CO2发生反应;A中溶液里一定还存在NaCl。写出NaOH与CO2发生反应的化学方程式_________。
(2)[实验步骤]中的现象_____(填“能”或“不能”)证明NaOH与CO2发生了反应。
(拓展迁移)对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明反应发生了。