题目内容
【题目】物质X在5g氧气中充分燃烧,反应方程式为X+3O2![]() RO2+2SO2(R为某种未知元素),测得RO2和SO2的质量分别为2.2g和6.4g,下列判断正确的是
RO2+2SO2(R为某种未知元素),测得RO2和SO2的质量分别为2.2g和6.4g,下列判断正确的是
A.RO2中R的化合价为+2价B.X中含有R、S、O三种元素
C.参加反应的X的质量为3.6gD.反应后的混合物中有三种物质
【答案】D
【解析】
A、氧元素通常为-2价,设R的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:x+(-2)×2=0,x=+4,不符合题意;
B、解:设RO2的相对分子质量为m,参加反应的氧气的质量为n
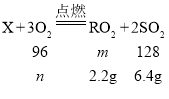
![]() n=4.8g
n=4.8g
![]() m=44
m=44
RO2中氧元素的质量为:![]() ;
;
SO2中氧元素的质量为:![]() ;
;
根据质量守恒定律,化学反应前后,元素的质量不变,生成物中含R、S、O,故反应物中一定含R、S、O,则X中一定含R、S,由于1.6g+3.2g=4.8g,与消耗氧气的质量相等,故X中不含氧元素,不符合题意;
C、根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,故参加反应的X的质量为:2.2g+6.4g-4.8g=3.8g,不符合题意;
D、由以上分析可知,5g氧气,消耗了4.8g,故氧气有剩余,反应后的混合物中有RO2和SO2以及剩余的氧气三种物质,符合题意。
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
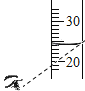
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是_____(填A或B)。
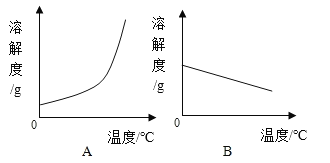
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。其中措施正确的是_____。
A ②④⑥ B ③④ C ①③⑤⑥ D ①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为_____。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙_____甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____。
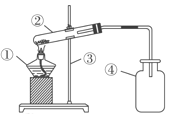
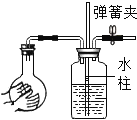
【题目】某班学生在老师指导下探究铁与水蒸气的反应,请帮助他完成下列实验报告。
(1)按图甲装好药品,连接装置(夹持仪器已略去)。其中A装置的作用是:_______
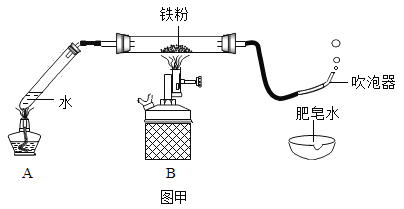
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中FeO接触到空气会立即由黑色变为红棕色;铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
倒出玻璃管中黑色固体,平铺于白纸上 | 黑色固体不变色 | 黑色固体中一定没 有_____(填物质名称) |
取上述黑色固体少许,装入试管,加入足量硫酸铜溶液 | _____ ,有红色固体出现 | 黑色固体中一定 含有_____。 |