��Ŀ����
������;�㷺����ṹ�����ʵ��ǻ�ѧ����Ҫ�о����ݡ�
��1����ͼ������ԭ�ӽṹʾ��ͼ������˵������ȷ����_______��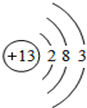
| A����ԭ���е�������Ϊ13 |
| B���ڻ���������ͨ����+3�� |
| C�����ǵؿ��к�������Ԫ�� |
| D���������������������������õĵ����� |

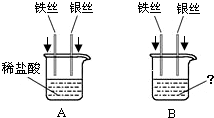
��������⡿��ҺA�е����ʿ�������Щ��
���������롿
�� ֻ��Zn��NO3��2 �� Zn��NO3��2��AgNO3
�� Zn��NO3��2��Cu��NO3��2 �� Zn��NO3��2��Cu��NO3��2��AgNO3
���������ۡ��������IJ�����_______�����ţ�����������_______��
��ʵ��̽����������ٳ�����ͨ������ʵ���ȷ������B�ijɷ֣��뽫�±���д������
| ʵ�鲽�� | ���� | ʵ����� |
| ȡ��������B���μ�_______ | �����ݲ��� | ����B����Cu ��Ag��_ |
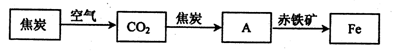
��3�����Ͳ������� Fe �۾��й㷺����;��������ͨ Fe �۸�����������Ӧ�����Ʊ�����������ͼ��ʾ��
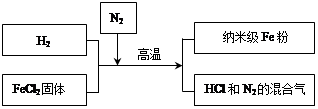
��ش��������⣺
������Fe���ڿ���������ȼ��ʵ����ͨ��N2��Ŀ����_______��
��д��H2��ԭFeCl2���û������Ļ�ѧ����ʽ_______��
���о���Ա��������Ƶõ����� Fe ����Ʒ�л��������� FeCl2���ʡ�ȡ��Ʒ20g���������������ᣬ�������� 0.7 g����������Ʒ�е��� Fe ��������������д��������̣���_______
��1��C
��2���� ZnӦ����AgNO3��Ӧ������Cu(NO3)2��Ӧ,����AgNO3ʣ��ʱ��������һ������Cu(NO3)2ʵ�鲽�� ���� ʵ����� ϡ���ᣨ��ϡ����ȣ� Zn
��3���ٷ�ֹ���ɵ��������۱���������H2+FeCl2 Fe+2HCl����98%
Fe+2HCl����98%
�������������
��ԭ�ӽṹʾ��ͼ�У�ԲȦ�ڵ����ֱ�ʾ��������A��ȷ����ԭ������������Ϊ3����Ӧ����ʧȥ�������ӣ��ʻ�ѧ��ͨ����+3�ۣ�B��ȷ�����ǵؿ��к������Ľ���Ԫ�أ�C���������нϺõĵ����ԣ��ʿ������ߣ�D��ȷ��
��Zn���뵽AgNO3��Cu��NO3��2�����Һ�У���������������Ӧ������������Ӧ��ʧ��ʣ���п��������ͭ��Ӧ���������ͭ����Ӧû�ˣ�пʣ�ࡣ����������ʵ�����ǿ��Եó�����һ�����ۣ�������������ͭ���Ⱥ�˳��Ӧ�����ʲ���ڲ���ȷ������������������£�����ͭ��û���뷴Ӧ��һ��Ҳ���ڡ�����Һ��ֻ������п�������п�ѽ�������������ͭȫ����Ӧ���ˣ���ʱп��������ʣ�ࡣ��ⷽ���Ǽ���ϡ�ᣬ��ΪпΪ���ý���������ϡ��ز������ݡ�
�Ǣ�ͨ����Ŀ��Ϣ����������ͨ�뵪��Ŀ���Ǹ����������Է�����ȼ�շ�Ӧ��
���ȸ���������������������������ٽ���������Ʒ�������õ���������������������������£�
�⣺��Fe������Ϊx
Fe + 2HCl=FeCl2 + H2��
56 2
x 0.7g
x="19.6g" 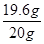 ��100%= 98%
��100%= 98%
�𣺸���Ʒ�е���������������Ϊ98%
���㣺��ѧ���㣬ԭ�ӽṹʾ��ͼ��������ѧ����

 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�����ʮ�ŷɴ�����2013�������롰�칬һ�š�����Խ�
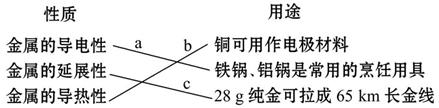
��1�����ѺϽ����dz�Ϊ����״����Ͻ𡱣��������ķɴ���չ���ߣ����ڴ������������ϵ�����������ǣ��� ����
| A��������״���书�ܣ� | B�����м��͵��۵㣻 | C���������õ���չ�ԣ� | D���������õĵ����� |
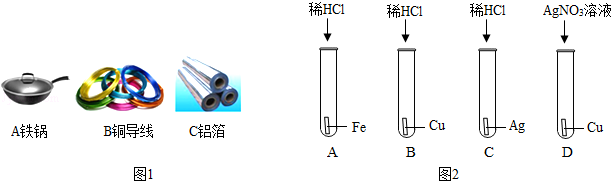
�� ���û�ѧʽ���̱�ʾ������δ��ĥ����ƬͶ��ϡ�����У��������̲������ݣ����û�ѧ����ʽ����ԭ���� ��