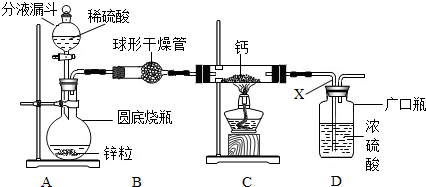
题目内容
氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.若制取8g氢气,需要消耗多少氢化钙?
【答案】分析:根据计算题的计算步骤:解、设、找出已知量和待求量、列出比例式、解出答案,再答.
解答:解:设消耗氢化钙的质量为x
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
x 8 g
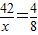 ,x=84g
,x=84g
答:若制取8g氢气,需要消耗84g氢化钙.
故答案为:84g.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小.
解答:解:设消耗氢化钙的质量为x
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
x 8 g
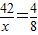 ,x=84g
,x=84g 答:若制取8g氢气,需要消耗84g氢化钙.
故答案为:84g.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,难度较小.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目