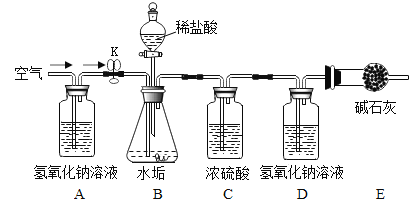
题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有Na2SO4、MgCl2、CaCl2以及泥沙等杂质.为了有效将粗盐提纯,实验的各步操作流程如下:(所加试剂a均为过量)
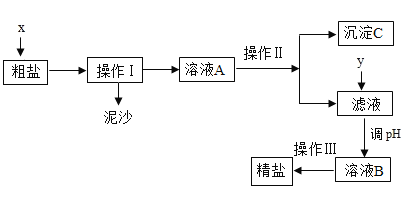
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的物质X是___.
(2)a所用的试剂按滴加的先后顺序依次为:氢氧化钠溶液、氯化钡溶液和碳酸钠溶液.其中氯化钡溶液和碳酸钠溶液的顺序不能颠倒,若颠倒,其后果是___.
(3)进行操作Ⅱ和操作Ⅲ都要有用到的仪器有玻璃棒和___.
(4)沉淀C中的成分是Mg(OH)2、___(填化学式).
(5)在滤液中加入y并调节pH的目的是为了除去___.
(6)实验最终所得精盐的质量大于粗盐中氯化钠的质量,原因是粗盐提纯过程中有新的NaCl生成,整个过程中产生新的NaCl的反应共有___个.
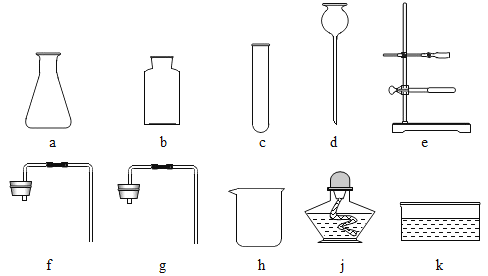
(7)请你写出用pH试纸检测溶液B酸碱度的具体操作:取一小段pH试纸放在洁净的点滴板上,___.
【答案】H2O(或水) 会引入新的杂质氯化钡(或加入的氯化钡无法除去) 铁架台 BaSO4、BaCO3和CaCO3 过量的氢氧化钠和碳酸钠 6 玻璃棒蘸取(或用胶头滴管取)少许溶液B(或待测液)点(或滴)在pH试纸上,把试纸显示的颜色与标准比色卡比较,即可读出溶液的pH
【解析】
(1)海水晾晒得到的粗盐是固体,要进行提纯,需要先加水溶解;
(2)碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,因此加入Na2CO3溶液的目的是除去溶液中的钙、钡离子;氯化钡溶液和碳酸钠溶液的顺序不能颠倒,若颠倒会引入新的杂质氯化钡;
(3)分离固体与溶液的方法是过滤,I、II都是分理处沉淀的过程.食盐通过蒸发结晶析出,操作Ⅲ是蒸发操作,操作Ⅱ和操作Ⅲ都要用到的仪器有玻璃棒和铁架台;
(4)根据(2)可知沉淀的成分有:BaSO4、CaCO3.另外还有氯化钡和碳酸钠过量,所以碳酸钠溶液和氯化钡溶液反应,还会生成氯化钠和碳酸钡沉淀BaCO3;
(5)加入适量HCl调节pH的目的是除去过量NaOH、Na2CO3;
(6)在粗盐提纯的过程中,在提纯过程中生成了氯化钠.所以实验所得精盐的质量大于粗盐中NaCl的质量.整个过程中产生新的NaCl的反应共有:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl,BaCl2+Na2SO4═BaSO4↓+2NaCl,BaCl2+Na2CO3═BaCO3↓+2NaCl;另外过量的 氢氧化钠和碳酸钠用盐酸来调节pH,也生成氯化钠,所以一共6个;
(7)测定pH最简单的方法是使用pH试纸,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH,这是检验溶液pH的正确方法。

【题目】请回答下列生活、生产中的化学问题:
(1)“补铁、补血、效果好!补血口服液!”、“葡萄糖酸锌口服液,蓝瓶的、好喝”.广告中的铁、锌是指人体需要的___(“常量”或“微量”)元素.
(2)如表所示的是某同学的午餐食谱.为了使营养均衡,你建议应该增加的食物是___(任写一种).
主食 | 米饭 |
副食 | 红烧肉 糖醋鱼 排骨汤 |
饮料 | 牛奶 |
(3)某校九年级学生到郊外野炊,负责烧饭的同学引燃枯枝后,迅速往灶里塞满枯枝,结果燃烧不旺,并产生了很多浓烟,原因是___.
(4)地球表面约有7l%被水覆盖,但可供人类利用的淡水总量却不足1%.爱护水资源是每个公民的责任和义务.下列行为不属于生活中节约用水的是___(填字母).
A 洗澡擦香皂时关上喷头 B 用洗衣机洗一两件衣服
C 用洗菜、淘米的水浇花 D 洗碗筷时不间断地冲洗
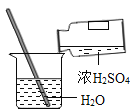
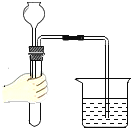
(5)实验中观察到的现象是___,试管内水面上升.当铁丝足量,时间足够长,进入试管的水的体积为___.
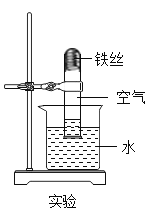
(6)若你骑自行车去郊游,回来用水清洗车后,你应采取的防锈措施是___.