题目内容
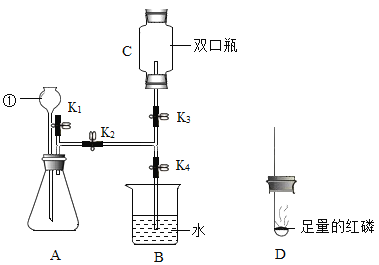
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
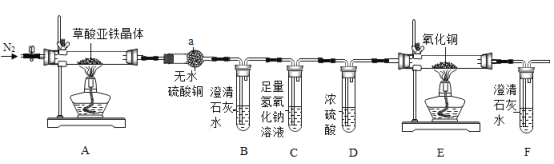
(1)实验中观察到仪器a中白色固体变蓝,可见草酸亚铁晶体分解产物中含有的物质是____。
(2)从绿色化学考虑,该套装置存在的明显缺陷是___________。
(3)实验前先通入一段时间N2,其目为__________。
(4)实验证明了气体产物中含有CO,依据的实验现为__________。
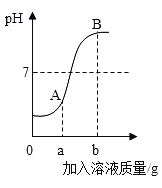
(5)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
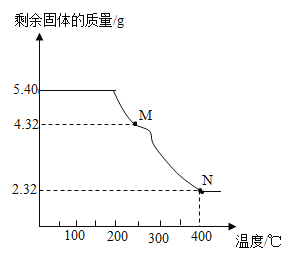
①上图中M点对应物质的化学式为_____。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_____。
【答案】水(或H2O) 缺少处理CO尾气装置 排尽装置内空气,防止空气中H2O和CO2的干扰 E中黑色粉末变红色,F出现白色沉淀(答全给分) FeC2O4 3FeC2O4 ![]() Fe3O4+2CO2↑+4CO↑
Fe3O4+2CO2↑+4CO↑
【解析】
(1)仪器a中无水硫酸铜变蓝,说明草酸亚铁晶体分解产物中含有水;
(2)该套装置缺少处理CO尾气的装置,可能污染环境;
(3)实验前先通入一段时间N2,其目的是排尽装置内空气,因为空气中的二氧化碳会使澄清石灰水变浑浊,空气中的水会使无水硫酸铜变蓝,从而影响检验草酸亚铁的分解产物;
(4)E中黑色氧化铜变红色,且F出现白色沉淀,说明氧化铜和一氧化碳发生反应生成了铜单质和二氧化碳,则证明了有一氧化碳生成;
(5)根据图像分析,温度较低时,固体质量不变,说明未发生反应,随温度升高剩余固体质量开始减少,M点时,固体质量减少了1.08g,而5.40g草酸亚铁晶体含有结晶水的质量=![]() ,恰好等于固体减少的质量,说明草酸亚铁晶体分解成了草酸亚铁和水,该过程发生的反应是:
,恰好等于固体减少的质量,说明草酸亚铁晶体分解成了草酸亚铁和水,该过程发生的反应是:![]() ,所以M点对应物质是FeC2O4;M-N过程,剩余固体的质量继续减小,直至2.32g,因为400℃时,剩余固体是铁的一种氧化物,而铁元素在整个过程中质量不变,则剩余固体中铁元素的质量=
,所以M点对应物质是FeC2O4;M-N过程,剩余固体的质量继续减小,直至2.32g,因为400℃时,剩余固体是铁的一种氧化物,而铁元素在整个过程中质量不变,则剩余固体中铁元素的质量=![]() ,那么氧元素的质量为
,那么氧元素的质量为![]() ,则化合物中铁和氧原子的个数比=
,则化合物中铁和氧原子的个数比=![]() ,所以该化合物为Fe3O4,故M-N过程是草酸亚铁分解生成四氧化三铁、二氧化碳和一氧化碳,化学方程式为:
,所以该化合物为Fe3O4,故M-N过程是草酸亚铁分解生成四氧化三铁、二氧化碳和一氧化碳,化学方程式为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案