题目内容
【题目】有一包白色粉末,可能由MgCl2、NaOH、BaCl2、Na2SO4、Na2CO3.中的一种或多种组成.取少量该白色粉末于烧杯中,向烧杯中加入足量水搅拌后,观察到有白色不溶物存在;再向烧杯中滴加酸溶液.根据加酸过程中观察到的现象绘制如下图象,结合图象判断下列说法合理的是 (注:本题中碳酸镁看作可溶)
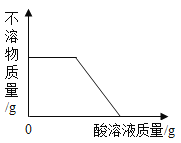
A.酸溶液不可能为稀硫酸B.白色不溶物可能为Mg(OH)2或BaSO4
C.原固体中可能只含有二种物质D.加水后得到的液体中可能含有OH-和CO32-。
【答案】CD
【解析】
氢氧根离子和镁离子会生成溶于酸的氢氧化镁沉淀,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,碳酸根离子和钡离子反应生成溶于酸的碳酸钡沉淀,所以
A、若白色粉末中含有氢氧化钠和氯化镁时,加入的酸可以是硫酸,故A错误;
B、根据图象,加入酸后,最后沉淀全部消失,而硫酸钡不溶于酸,不会完全消失,故B错误;
C、若白色粉末中含有氯化镁和氢氧化钠,生成的氢氧化镁沉淀溶于酸,加入酸后,沉淀消失,符合题意,故C正确;
D、根据图象,加入酸后,沉淀刚开始不消失,说明酸在与溶液中的物质反应,而能与酸反应的物质就是氢氧化钠,所以可判断加水后得到的液体中含有OH-和CO32-,故D正确。
故选:CD。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目