题目内容
【题目】某化学兴趣小组对如下两个实验进行探究: 第一小组:对久未盖瓶塞的过氧化氢溶液中的过氧化氢是否完全分解,进行如下探究。
(猜想与假设)猜想⑴:该溶液中过氧化氢未完全分解。 猜想⑵:该溶液中过氧化氢已完全分解。
(方案讨论)为了验证猜想,甲、乙、丙三同学分别提出如下方案 甲:取适量试剂于试管中,伸入带火星的木条,若带火星的木条复燃,则猜想⑴成立,若带火星的木条不复燃,猜想⑵成立。同学们认为此方案不行,原因是_______________。
乙:取少量二氧化锰于试管中,加入与甲等量的试剂,若有气泡产生,则猜想⑴成立.若无气泡产生,则猜想⑵成立,理由是____________(写反应的符号表达式)。
丙:取与甲等量的试剂于另一支试管中,加热,再伸入带火星木条,观察到的现象____________,则猜想⑴成立。
(反思与交流)
敞口放置的试剂容易变质,所以要____________保存。
二氧化锰在过氧化氢的分解过程中起催化作用。从本组实验中可得 知,能改变化学反应速率的方法还可以是____________。
第二小组:对人体吸入的空气与呼出的气体有什么不同,进行如下探究。
(提出问题)人体吸入的空气与呼出的气体组成有什么不同?
(查阅资料)①通常条件下,白磷与氢氧化钠溶液不反应。
②NaOH 能吸收二氧化碳生成碳酸钠和水。
(进行实验)
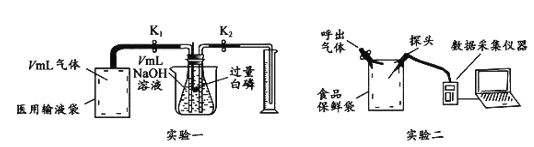
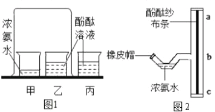
实验一:
①检查装置的气密性。装入试剂,在医用输液袋中装入 V mL 气体,连接装置;
② 缓慢挤压医用输液袋,将袋中气体全部排出,读出量筒中液体体积 V1mL;
③关闭 K1、K2,再向烧杯中加入热水,促使白磷迅速燃烧。待瓶中气体冷却至室温,打开 K2,读出量筒中液体体积为 V2 mL。
实验二: 将氧气、二氧化碳、水蒸气(测湿度)传感器探头放入有少量空气的保鲜袋中,打开仪 器开始采集数据,然后向袋内呼出气体。
(解释与结论)
(1)实验一步骤②中,横线处应补充的实验操作是____________。
(2)实验一步骤③中的 V2 mL 是除去了已反应的____________之外的气体总体积。
(3)实验一中,二氧化碳的体积分数是____________(用关系式表示)。
(4)实验二中,采集的数据如下图所示,纵坐标均为某气体的体积分数(%),横坐标 均为时间(S)。根据下图思考:
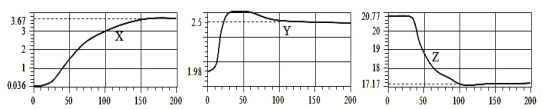
表示 O2 体积分数变化的曲线是____________(选填“X”、“Y”、“Z”)。
根据图 2 在实验中 200s 时没有采集数据的其余气体的总体积分数为____________。
【答案】常温下过氧化氢在没有催化剂的条件下分解缓慢,产生的氧气少,不能使带火星的木条复燃 H2O2![]() H2O+O2 有气泡冒出、带火星的木条复燃 密封 加热 关闭弹簧夹K1、K2 O2、CO2
H2O+O2 有气泡冒出、带火星的木条复燃 密封 加热 关闭弹簧夹K1、K2 O2、CO2 ![]() ×100% Z 76.66%
×100% Z 76.66%
【解析】
[方案讨论] 甲:常温下过氧化氢在没有催化剂的条件下分解缓慢,产生的氧气少,不能使带火星的木条复燃,故不能说明不剩余过氧化氢
乙:过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应的符合表达式为:H2O2![]() H2O+O2;
H2O+O2;
丙:猜想(1)成立,说明有氧气生成,故可以看到有气泡冒出、带火星的木条复燃;
[反思与交流] 试剂敞口放置会变质,要密封保存;
该反应中,加入二氧化锰后加快了反应的速率,而二氧化锰的质量和化学性质都没有改变,故二氧化锰是该反应的催化剂,起催化作用;由实验可知,加热也可能改变反应的速率;
[解释与结论]
(1)实验一:②打开弹簧夹K1、K2,缓慢将袋中的气体全部排除。读出量筒中液体体积为V1mL。故(1)实验一步骤②中,横线处应补充的实验操作是:打开弹簧夹K1、K2;
(2)关闭弹簧夹K1、K2,再向烧杯中加入热水,以促使白磷迅速燃烧。待瓶中气体冷却至室温,打开K2。读出量筒中液体体积为V2mL,其数值等于已反应的O2、CO2之外的气体总体积。
(3)NaOH 能吸收二氧化碳。二氧化碳的体积为(V-V1)。故实验一中,二氧化碳的体积分数是![]() ×100%;
×100%;
(4)人体呼出气体的主要成分是氧气、二氧化碳、水蒸气,且氧气减少,二氧化碳和水蒸气含量增加,二氧化碳含量大于水蒸气,故实验二中Z表示二氧化碳体积分数变化;
气体的总体积分数为100%,其中X占3.67%,Y占2.5%,Z占17.17%。故根据图 2 在实验中 200s 时没有采集数据的其余气体的总体积分数为:100%-3.67%-2.5%-17.17%=76.66%。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】生活离不开化学.
(1)豆浆已成为众多家庭喜爱的饮品,下表是豆浆中部分营养成分的平均质量分数,请根据下表回答问题:
成分 | 蛋白质 | 油脂 | 糖类 | 钙 | 铁 | 维生素 |
质量分数/% | 1.8 | 0.7 | 1.1 | 0.01 | 0.0005 | 0.015 |
①豆浆中含有人体所需的微量元素是______,青少年因缺_____而导致佝偻病.
②豆浆所含的营养素中不能供给人体能量,但可以起到调节新陈代谢作用的是_____.
(2)香烟燃烧产生的烟气中含有尼古丁(化学式为C10H14N2)、焦油和CO等有害物质,其中尼古丁属于____(填“有机物”或“无机物”),尼古丁中C、N两种元素的质量比为_____.
(3)胃酸过多的病人,其胃液的pH较正常人的要___(填“大”或“小”),服用含氢氧化铝的药物后可使病人恢复正常,原因是________(用化学方程式表示).
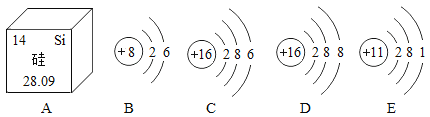
【题目】元素周期表是学习化学的重要工具。如图是元素周期表中的一部分,请回答下列问题:
第一周期 | 1 H | 2 He | ||||||
第二周期 | 3 Li | 4 Be | 5 B | ① | 7 N | ② | 9 F | 10 Ne |
第三周期 | 11 Na | 12 Mg | ③ | 14 Si | 15 P | 16 S | 17Cl | 18 Ar |
(1)表中①所示元素的名称是____________,②所示元素与③所示元素形成的化合物的化学式是___________________。
(2)元素周期表中同族和同周期元素具有一定的相似性和变化规律,同族元素化学性质相似的原因是:_________________相同。