题目内容
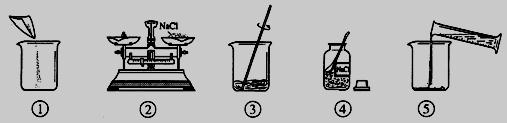
如图是配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
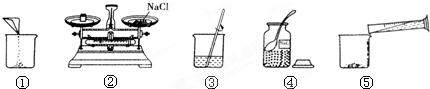
(1)图中的玻璃仪器分别是广口瓶、量筒、
(2)指出图②中的一处错误操作
(3)配制时应选择
(4)用已调好的天平称取
(5)用上述图示的序号表示配制溶液的操作顺序
(6)若量取水时俯视读数,则会使所配制的溶液溶质质量分数

(1)图中的玻璃仪器分别是广口瓶、量筒、
烧杯
烧杯
和玻璃棒,其中玻璃棒在此操作中的作用是搅拌以加速溶解
搅拌以加速溶解
.(2)指出图②中的一处错误操作
药品与砝码放置错误
药品与砝码放置错误
.(3)配制时应选择
100
100
(填10、50或100)mL的量筒量取95
95
mL所需的水.(4)用已调好的天平称取
5
5
g氯化钠固体时发现指针向右偏,接下来的操作是继续添加氯化钠直至天平平衡
继续添加氯化钠直至天平平衡
.(5)用上述图示的序号表示配制溶液的操作顺序
④②①⑤③
④②①⑤③
.(6)若量取水时俯视读数,则会使所配制的溶液溶质质量分数
偏大
偏大
(填“偏大、偏小或不变”)分析:本题考查的是配制一定溶质质量分数的溶液的实验,在操作时对于天平的使用及实验步骤要求熟记然后结合溶液中溶质质量分数的计算公式解答即可.
解答:解:(1)根据配制溶液的方法可以知道所缺仪器的名称为:烧杯,在该过程中玻璃棒的作用为加速氯化钠固体的溶解;
(2)托盘天平称量药品时,药品放在左盘,砝码放在右盘,分析图中所给的操作过程可以知道,而图中的药品与砝码放置放反了;
(3)配制溶液时所需水的质量为:100g-100g×5%=95g;由密度公式可得水的体积为95mL,因此需选择100mL的量筒;
(4)所需氯化钠的质量为:100g×5%=5g,称量时若发现指针向右偏,则说明所取氯化钠质量较少,所以应该继续添加氯化钠直至天平平衡;
(5)配制溶液的步骤为计算、称量、溶解、装瓶保存.因此顺序为:④②①⑤③
(6)量取水时俯视读数,则会使量取的水的体积偏少,而使所配制的溶液溶质质量分数偏大.
故答案为:(1)烧杯;搅拌以加速溶解;
(2)药品与砝码放置错误;
(3)100;95;
(4)5g;继续添加氯化钠直至天平平衡;
(5)④②①⑤③
(6)偏大.
(2)托盘天平称量药品时,药品放在左盘,砝码放在右盘,分析图中所给的操作过程可以知道,而图中的药品与砝码放置放反了;
(3)配制溶液时所需水的质量为:100g-100g×5%=95g;由密度公式可得水的体积为95mL,因此需选择100mL的量筒;
(4)所需氯化钠的质量为:100g×5%=5g,称量时若发现指针向右偏,则说明所取氯化钠质量较少,所以应该继续添加氯化钠直至天平平衡;
(5)配制溶液的步骤为计算、称量、溶解、装瓶保存.因此顺序为:④②①⑤③
(6)量取水时俯视读数,则会使量取的水的体积偏少,而使所配制的溶液溶质质量分数偏大.
故答案为:(1)烧杯;搅拌以加速溶解;
(2)药品与砝码放置错误;
(3)100;95;
(4)5g;继续添加氯化钠直至天平平衡;
(5)④②①⑤③
(6)偏大.
点评:本题考查了溶液的配制,完成此题,可以依据已有的知识结合溶质质量分数公式进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题:
25、如图是几种固体物质的溶解度曲线.请根据图回答下列问题:
 (2008?鄂州)如图是几种固体物质的溶解度曲线.请根据图完成10~12题.
(2008?鄂州)如图是几种固体物质的溶解度曲线.请根据图完成10~12题.