��Ŀ����
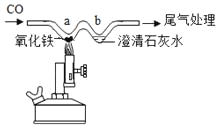
����Ŀ��ij���ʳ������������̼�������ʣ�������һ��ʯ��ʯ(�������ʲ��μ��κη�Ӧ)�����ҵ�����ȡ��������ȷ���۸�����ȡ��2g������20 gϡ������Ĵμ��룬��ַ�Ӧ��ÿ��ʣ������������±�:

(1)2gʯ��ʯ��Ʒ�к������ʵ�������___________�ˡ�ʯ��ʯ��Ʒ��̼��Ƶ�����������___________ (�ðٷ�����ʾ)��
(2)1000 kg����ʯ��ʯ������պɵö�����̼�������Ƕ���___________?(д������ļ������) (����ʯ��ʯ�Ļ�ѧ����ʽΪ![]() )
)
���𰸡�0.4g 80% 352kg
��������
̼��ƺ�ϡ���ᷴӦ����������ˮ���Ȼ��ơ�ˮ��������̼�����Թ�����ٵ�������Ϊ��Ӧ����̼��Ƶ����������ʣ�����Ϊ���ʡ�
(1)��������Ϣ��֪��ʯ��ʯ��Ʒ�е�����Ϊ0.4g��̼���Ϊ2g-0.4g=1.6g��
̼��Ƶ���������Ϊ��![]() 80%��
80%��
(2)��1000 kg����ʯ��ʯ������պɵö�����̼��������x
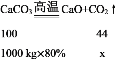
![]()
x=352kg��
.

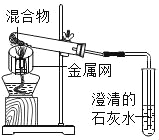
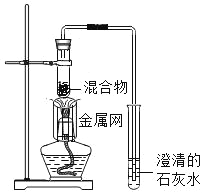
����Ŀ��Ϊ̽��̼��ԭ����ͭ�����ʵ����������ľ̿�ۺ�����ͭ�ĸ�������1��2.5g����ϵ��ʵ�顣
���������ϣ�̼��ԭ����ͭ�õ���ͭ�п��ܺ���������ɫ��������ͭ������ͭԪ�صĻ��ϼ�Ϊ+1�ۣ���
������ʵ�飩ʵ��1��ȡ������Ϊ1��11��ľ̿�ۺ�����ͭ�����1.3g������ʵ�顣
��� | 1��1 | 1��2 |
װ�� |
|
|
��Ӧ�����ʵ���ɫ��״̬ | ��ɫ��ĩ�л���������ɫ���� | ��ɫ�����н��������м�������ɫ���� |
ʵ��2��ȡһ�����Ļ�����1��2װ�ý���ʵ�顣
��� | ľ̿��������ͭ�������� | ��Ӧ�����ʵ���ɫ��״̬ | |
2��1 | 1��9 | ��ɫ�����н������� | ����������ɫ���� |
2��2 | 1��10 | ���к�������ɫ���� | |
2��3 | 1��11 | ���м�������ɫ���� | |
2��4 | 1��12 | ��ɫ���� | |
2��5 | 1��13 | ���н϶��ɫ���� | |
��1��������ͭ�Ļ�ѧʽΪ_____��
��2��ʵ��1��2�У�֤�������˶�����̼��������_____����صĻ�ѧ��Ӧ����ʽΪ_____��
��3��ʵ��1��2�У�����Ӧ�������Ƚ������ܴ�ʯ��ˮ��ȡ����Ȼ��ر�ֹˮ�У��ò�����Ȼ��ȴ�������ر�ֹˮ�У����ܳ��ֵ�������_____��
��4��ʵ��1��Ŀ����_____��
��5��ʵ��2�Ľ�����_____��
����˼�����ۣ�
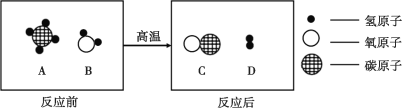
��1����ͬѧ�����ó�ϸ̿��������ͭ��ĩ����ʵ�顣����Ϊ���������������_____��
��2��ʵ��2δ����������Ϊ1��14��ʵ�飬������_____��