题目内容
【题目】(10分)工业上用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,某化学兴趣小组的同学将其产物进行过滤,并对滤液进行如下探究。
【提出问题】滤液中含有哪些溶质?
【猜想与假设】假设一:滤液中只含氢氧化钠 假设二:滤液中含氢氧化钠和碳酸钠
假设三:滤液中含
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠
【进行实验】甲同学设计了如下实验方案:
实验步骤 | 实验现象 | 结论 |
取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀 | 碳酸钠过量 |
若无明显现象 | 恰好反应 |
【反思与评价】
(1)碳酸钠溶液与石灰水反应的基本类型为 。
(2)乙同学认为假设四不合理,理由是 。
(3)丙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由是 。
(4)丁同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础上进行实验。她的实验方案是:
实验步骤 | 实验现象和结论 |
【定量研究】
(5)戊同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。反应时CaCl2溶液与沉淀的质量关系如图所示。
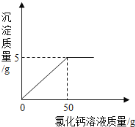
①样品中氢氧化钠的质量为 g;
②计算所加CaCl2溶液中溶质的质量分数。(写出计算过程)
【答案】【猜想与假设】假设三: 氢氧化钠和氢氧化钙
【反思与评价】
(1)复分解反应
(2)因为氢氧化钙溶液与碳酸钠溶液不能共存。
(3)若氢氧化钙过量,滴加氯化钙溶液也无明显现象
(4)
实 验 步 骤 | 实 验 现 象 和 结 论 |
取少量甲同学实验用的原滤液放在试管中,在通入足量的二氧化碳(或滴入Na2CO3溶液),观察 | 溶液无变化,则不含氢氧化钙 |
溶液变浑浊,则含氢氧化钙 |
【定量研究】(5)①73.5 ② 11.1%
【解析】
试题分析:
【猜想与假设】碳酸钠与氢氧化钙反应生成的是氢氧化钠和碳酸钙沉淀。若碳酸钠与氢氧化钙恰好完全反应,那么反应后的滤液中只含有氢氧化钠;若碳酸钠过量,那么滤液中含有氢氧化钠和碳酸钠;若氢氧化钙过量,那么滤液中含有氢氧化钠和氢氧化钙;
【反思与评价】(1)碳酸钠与氢氧化钙反应生成的是氢氧化钠和碳酸钙沉淀,该反应是两种化合物相互交换成分生成另外两种化合物,属复分解反应;
(2)由于碳酸钠与氢氧化钙反应不能共存,故不可能同时存在碳酸钠和氢氧化钙;
(3)由于滴加的氯化钙溶液只能与碳酸钠溶液反应,即只能检验碳酸钠是否过量,而不能判断氢氧化钙是否过量,故不合理;
(4)要判断该滤液中是否含有氢氧化钙,可向滤液中滴加碳酸钠溶液,若产生白色沉淀,则证明含有氢氧化钙,若没有沉淀,则证明滤液中不含氢氧化钙;
(5)碳酸钠与氯化钙反应生成的是氯化钠和碳酸钙沉淀:CaCl2+Na2CO3==CaCO3↓+2NaCl,根据图像可知生成的沉淀的质量为5g,利用化学方程式,根据反应的质量比即可计算出碳酸钠的质量和氯化钙的质量。
设碳酸钠的质量为x,氯化钙的质量为y,
CaCl2+Na2CO3==CaCO3↓+2NaCl
111 106 100
Y X 5g
106/100 =x/5g 111/100 =y/5g
X=5.3g y=5.55g
由于取的是A溶液的1/5,故碳酸钠的总质量=5.3g×5=26.5g
样品中氢氧化钠的质量=100g-26.5g=73.5g
所加CaCl2溶液中溶质的质量分数=5.55g/50g ×100% =11.1%
答:略

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊实验后,对呼出的气体中主要成分及含量非常好奇,设计了如下实验进行探究。
【提出问题】呼出的气体中有哪些主要成分,它们的含量是多少?
【查阅资料】①呼出的气体中仍含有O2。②CO2在饱和NaHCO3溶液中的几乎不溶解。③白磷燃烧需要氧气,白磷燃烧所需的最低温度为40℃,燃烧现象和产物均与红磷相同。④氢氧化钠溶液能吸收二氧化碳,并与二氧化碳反应生成碳酸钠和水。
【猜想与实践】猜想:呼出的气体中主要成分是N2、O2、CO2、水蒸气等。
实验Ⅰ:验证呼出的气体中含有水蒸气。
(1)实验操作:取一洁净干燥的玻璃片,对着其哈气,观察到________,可以判断呼出的气体中含有水蒸气。
实验Ⅱ:验证呼出的气体中含有N2、O2、CO2,并测其含量。同学们在老师的指导下设计了如图所示装置(B是带有刻度的量气装置)。
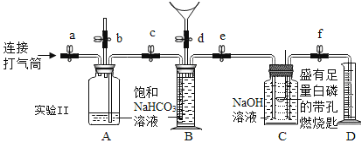
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性,向装置中加入药品,关闭止水夹a~f。 | (不填) | 装置的气密性良好 |
② | 打开b、c、d,向B中吹入一定量气体后关闭d,并冷却到室温。 | B中液体进入到A中,B中液体减少500ml。 | 收集了500ml气体 |
③ | 关闭b,打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出 | A中的液面下降,B中的液面上升至最高,C中的左侧导管口有 ①_______,且液面下降,液体沿导管进入D中,D中液体为475ml | 呼出气体中含有CO2 |
④ | 关闭e、f,用凸透镜聚光引燃白磷. | 白磷燃烧,产生大量白烟,放出大量热 | 呼出气体中含有O2,该反应的文字表达式为: ②____________ |
⑤ | 待白磷熄灭并冷却到室温,打开f。 | D中液体倒吸入C瓶中,C瓶中液面上升,D中剩余液体为400ml。 | 呼出气体中含有 ③____________。 |
同学们经过3次重复实验,确认了呼出的气体中的主要成分及其含量。
【实验反思】
(3)该实验设计依据的N2性质有__________(填字母序号)。
A.难溶于水
B.不能和NaOH溶液反应
C.不能燃烧,也不支持燃烧
D.无色无味的气体
(4)在实验(2)的操作⑤中,未等C中的气体的冷却,就打开f止水夹读数,则所测的O2的体积分数会_____(填“偏大”、“不变”、或“偏小”) 。