题目内容
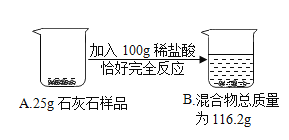
【题目】实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
请根据以上信息计算:样品中碳酸钙的质量分数?
【答案】80%
【解析】
试题分析:首先根据质量守恒定律,计算出二氧化碳的质量=100g+25g-116.2g=8.8g,然后根据二氧化碳的质量,利用化学方程式计算出碳酸钙的质量,最后用碳酸钙的质量除以样品的质量。具体步骤如下:
解:设样品中碳酸钙的质量为X
根据题意知,产生二氧化碳的质量=100g+25g-116.2g=8.8g
CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O
100 44
X 8.8g
100/44=X/8.8g X=20g
所以样品中碳酸钙的质量分数=20g/25g*100%=80%
答:样品中碳酸钙的质量分数为80%。

练习册系列答案
相关题目


