题目内容
【题目】海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。下图是某厂生产纯碱的工艺流程图:
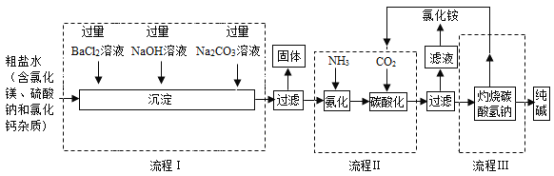
(1)流程I中加入药品的顺序还可以是_______。
(2)流程I中为了除去杂质,加入过量BaC12溶液、NaOH溶液和NaCO3溶液。请分析加入过量的碳酸钠溶液的作用是_______;过滤后得到的沉淀含______种物质。
(3)下列关于流程Ⅱ的说法错误的是_____(填字母序号)。
A流程Ⅱ所涉及的反应物中共有六种元素
B“侯式制碱法”制得的碳酸钠俗称纯碱,它属于盐类物质
C过滤得到的“母液”中只有一种溶质
(4)若在上述制取纯碱的过程中CO2和NH3都是可以循环使用的物质,试写出一种再获得NH3的一个最佳的反应方程式:_______。
【答案】过量氢氧化钠溶液→过量氯化钡溶液→过量碳酸钠溶液或过量氯化钡溶液→过量碳酸钠溶液→过量氢氧化钠溶液; 除去氯化钙和过量的氯化钡; 4; C; ![]()
【解析】
(1)加入碳酸钠的作用是除去氯化钙和过量的氯化钡,因此碳酸钠要在氯化钡之后加入,而氢氧化钠的加入没有顺序要求,故填:过量氢氧化钠溶液→过量氯化钡溶液→过量碳酸钠溶液或过量氯化钡溶液→过量碳酸钠溶液→过量氢氧化钠溶液;
(2)加入碳酸钠的作用是除去氯化钙和过量的氯化钡,故填:除去氯化钙和过量的氯化钡;
过滤后得到硫酸钡、碳酸钡、氢氧化镁、碳酸钙等四种沉淀,故填:4;
(3)A、流程Ⅱ的主要反应方程式为:![]() ,共涉及6种元素,不符合题意;
,共涉及6种元素,不符合题意;
B、碳酸钠由碳酸根离子和钠离子构成,属于盐,俗称纯碱,不符合题意;
C、过滤所得滤液是碳酸氢钠的饱和溶液,因此溶质不仅是氯化铵,符合题意;故选:C;
(4)还可用副产品氯化铵制取氨气,故填:![]()

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组欲利用其进行下列各实验。

(1)以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体。按照要求设计实验装置、连接仪器,并检验装置的气密性。
①装置A中仪器甲的名称是________。
②用石灰石和稀盐酸制取二氧化碳的化学方程式为________。
③所选仪器的连接顺序为________(从左至右填写仪器序号字母)。(提示:挥发出的少量HC1气体可用饱和碳酸氢钠溶液吸收)
(2)实验室中用锌和稀硫酸来制备氢气以测定某氧化铜样品中CuO的质量分数(杂质为Cu),所选仪器的连接A→E1→C→E2→碱石灰干燥管,实验前检查装置的气密性。(已知:![]() ;E1、E2为盛浓硫酸洗气瓶)使一定质量的该氧化铜样品与氢气充分反应,观察实验现象,收集相关实验数据(假设发生的反应都充分完全进行)。
;E1、E2为盛浓硫酸洗气瓶)使一定质量的该氧化铜样品与氢气充分反应,观察实验现象,收集相关实验数据(假设发生的反应都充分完全进行)。
①在该装置中,洗气瓶E1的作用是______,E2的作用是_______。
②化学实验充分反应后记录实验数据(质量单位为g),如下表所示:
装置编号 | E1中浓硫酸 | C中玻璃管内固体 | E2中溶液 |
实验前质量 | m | w | n |
实验后质量 | a | b | c |
选择合理实验数据计算该氧化铜样品中氧化铜的质量分数是______×100%。(用上表中的字母,以分式形式表示)
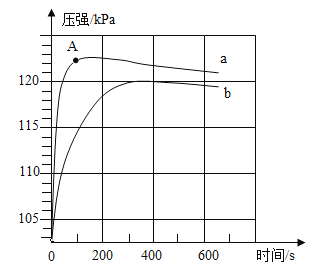
【题目】如下图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是( )
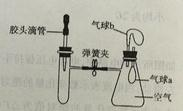
试管内物质 | 胶头滴管内物质 | |
A | 氢氧化钠固体 | 水 |
B | 氧化铁 | 稀盐酸 |
C | 氯化钡溶液 | 稀硫酸 |
D | 二氧化碳 | 氢氧化钠溶液 |
A.AB.BC.CD.D