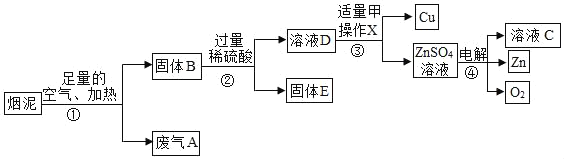
题目内容
【题目】复分解反应是我们学过的基本反应类型之一.学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系.
(1)写出下列反应的化学方程式:
①碳酸钾溶液与石灰水反应_____;
②碳酸钾和稀盐酸混合_____;
③氢氧化钡与稀硝酸混合_____.
(2)你想到上述复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如上述①中,实际参加反应的离子是CO32﹣和Ca2+,而K+和OH﹣则是“旁观者”,并没有参加反应.请你分析上述反应②中实际参加反应的离子是_____,上述反应③中实际参加反应的离子是_____.
【答案】K2CO3+Ca(OH)2═CaCO3↓+2KOH K2CO3+2HCl═2KCl+CO2↑+H2O Ba(OH)2+2HNO3═Ba(NO3)2+2H2O CO32﹣、H+ OH﹣、H+
【解析】
复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应。
(1)①碳酸钾能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,化学方程式为
![]() 。
。
②碳酸钾能和盐酸反应生成二氧化碳、水和氯化钾,化学方程式为![]() 。
。
③氢氧化钡与硝酸能反应生成硝酸钡和水,化学方程式为
![]() 。
。
(2)实际参加反应的离子是能结合成沉淀、气体或水的离子,所以②中实质是碳酸根离子与氢离子,化学符号为![]() ③中反应实质是氢氧根离子和氢离子,化学符号为
③中反应实质是氢氧根离子和氢离子,化学符号为
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组利用稀盐酸和澄清石灰水展开“酸碱中和反应”的实验探究活动。请你参与他们的实验活动,并回答相关问题
(提出问题Ⅰ)稀盐酸和澄清石灰水能否发生反应?
(实验1)小明取一定量的稀盐酸,测得其pH=2,然后向其中加入一定量的澄清石灰水后,测得混合溶液的pH=3,于是得出“稀盐酸和澄清石灰水发生了中和反应”的结论。
测定溶液pH的方法是:将pH试纸放在玻璃片上,___,将试纸显示的颜色与标准比色卡比较。
小刚认为,小明的实验方案不能证明二者发生了中和反应,理由是___。
(实验2)小刚取稀盐酸于试管中,加入一定量的澄清石灰水,得到溶液X,再加入适量铁粉,观察到___,证明稀盐酸和澄清石灰水发生了反应。
稀盐酸和澄清石灰水反应的化学方程式为___。
(提出问题Ⅱ)溶液X中溶质的成分是什么?
猜想一:只有CaCl2;猜想二:CaCl2和Ca(OH)2;猜想三:CaCl2和HCl
小组同学为验证猜想二,进行了如下实验(查阅资料显示CaCl2溶液显中性)
实验操作 | 实验现象 | 实验结论 | |
实验3 | 取适量溶液X于试管中,滴加紫色石蕊溶液 | ___ | 猜想二成立 |
实验4 | 取适量溶液X于试管中,滴加Na2CO3溶液 | 产生白色沉淀 | 猜想二成立 |
小明认为实验4中产生白色沉淀,并不能证明猜想二成立,理由是____。
请你另选一种试剂,设计合理的方案,当观察到与实验4相同的现象时,证明猜想二成立。你的实验原理是___(用化学方程式表示)。