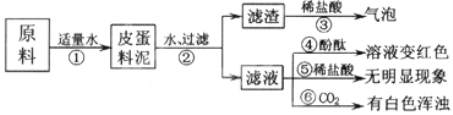
题目内容
【题目】钢铁是目前使用最多的金属材料。
(1)生铁和钢都是铁合金,其中含碳量较高的是_______。
(2)人们常用“铜墙铁壁”来形容物体的坚固,但铁在一定条件下也能发生各种反应,如铁丝在氧气中燃烧,反应的化学方程式是_______。
(3)将mg氧化铜加入稀硫酸中完全溶解(反应生成硫酸铜和水)后,再加入铁粉充分反应,过滤,得到滤渣A和滤液B。再将滤渣A加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量为12.8 g。①滤渣A的成分是_______,滤液B的成分是_______。②原氧化铜的质量m=_______g。
【答案】 生铁 3Fe+2O2![]() Fe3O4 Cu、Fe FeSO4、H2O 16
Fe3O4 Cu、Fe FeSO4、H2O 16
【解析】(1)、生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金;(2)、铁丝在氧气中燃烧生成四氧化三铁,写出反应的化学方程式即可;(3)、根据反应过程分析滤渣A,滤液B的成分;根据化合物的质量=化合物中某元素的质量÷化合物中该元素的质量分数解答。解:(1)、生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,其中含碳量较高的是生铁;(2)、铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2点燃Fe3O4;(3)、氧化铜和硫酸反应生成硫酸铜和水,再加入铁粉,铁和硫酸铜反应生成硫酸亚铁和铜;充分反应,过滤,得到滤渣A和滤液B。向滤渣A中加入足量的稀硫酸,有气泡冒出说明铁粉有剩余,所以滤渣A是铁和铜的混合物,滤液B就是硫酸亚铁溶液;而剩余固体物质就是铜,其质量是12.8g,所以氧化铜的质量=12.8g÷![]() ×100%=16g。
×100%=16g。

【题目】三明市民新水泥厂化验室,为了测定其矿山石灰石中碳酸钙的质量分数,取石灰石样品与是量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)。有关实验数据如下表:
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
150g | 12g | 157.6g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为_______g。
(2)求该石灰石中碳酸钙的质量分数为__________。