题目内容
【题目】下列各组图像可能描述同一个反应的是
A.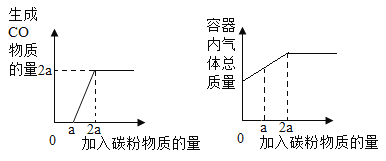
B.
C.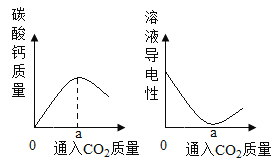
D.
【答案】AC
【解析】
A、a摩尔的碳与a摩尔的氧气在密闭容器中反应生成a摩尔的二氧化碳,生成一氧化碳物质的量为零,a摩尔的二氧化碳与a摩尔的碳反应生成2a摩尔的一氧化碳,反应中密闭容器中的气体的质量逐渐增加直至a摩尔二氧化碳与a摩尔碳反应生成2a摩尔的一氧化碳为止,即两个图像能描述同一个反应,选项正确;
B、碳酸钙与一定量的稀盐酸反应生成氯化钙、水和二氧化碳,如果稀盐酸不足,则反应中碳酸钙中的质量逐渐减少直至反应停止时碳酸钙有少量剩余,稀盐酸完全反应,反应中溶液的pH应该由小于7开始逐渐变大,直至最后等于7,不会大于7,所以两个图像不能描述同一个反应,选项错误;
C、向氢氧化钙溶液中不断通入二氧化碳,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,溶液中碳酸钙的质量逐渐增加,直至氢氧化钙完全反应,同时随着氢氧化钙的逐渐减少,溶液的导电性逐渐降低直至氢氧化钙完全反应,溶液的导电性几乎为零,继续通入二氧化碳,二氧化碳与碳酸钙、水反应生成可溶性的碳酸氢钙,溶液中的碳酸氢钙逐渐增加,溶液的导电性逐渐增强,直至碳酸钙与二氧化碳和水完全反应,即两个图像能描述同一个反应,选项正确;
D、锌与硫酸铜反应生成硫酸锌和铜,随着反应的进行,溶液中硫酸铜的质量逐渐减少直至硫酸铜完全反应时硫酸铜的质量为零,由化学方程式Zn+CuSO4=ZnSO4+Cu可知,参加反应的锌与生成的铜的质量比=65:64,所以随着锌与硫酸铜反应生成硫酸锌和铜,反应后的固体质量应该是减少的,即两个图像不能描述同一个反应,选项错误,故填AC。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
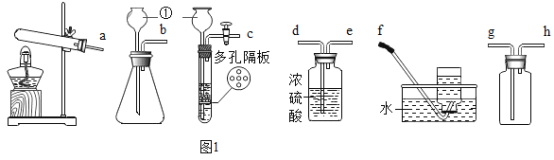
仁爱英语同步练习册系列答案【题目】氧气是我们身边无法离开的物质,某兴趣小组对氧气的研究如下:
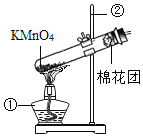
Ⅰ.氧气的制备:
(1)写出如图中有标号仪器的名称:①_____。
(2)该装置中棉花团的作用是_____,图中装置一处明显的错误是_____。
Ⅱ.氧气的收集:
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据
(3)三个实验均需重复3次的目的是_____。由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是_____。
(4)不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_____。
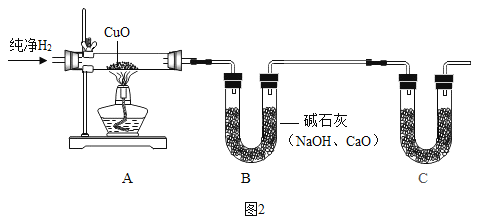
Ⅲ.铁丝在氧气中燃烧
(5)铁丝在纯净氧气中燃烧的化学方程式为_____。
(6)铁丝(含碳颗粒)燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是_____(填化学式)。
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为_________________。
[对比实验]
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_______________(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是____________________。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象 | 结论 | 推论 |
(1)向一支试管中再加入NaCl固体 | 铝丝表面析出红色固体 | 氧化铝薄膜被破坏 | Na+或___________能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 | ___ | 氧化铝薄膜未被破坏 | Na+和SO42-都不能破坏氧化铝薄膜 |
[结论与反思]得出结论:前述猜测___(填“正确”或“不正确”)
[拓展应用]家庭里的铝制品在使用时要避免与______________接触(填一种即可)
总结反思:本次探究充分运用了比较法和控制变量法
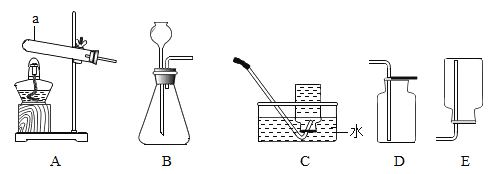
【题目】为探究某物质 X 对钢铁在潮湿环境下的腐蚀的影响作用,某同学进行了如下实验:
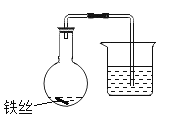
① 选择 6 个容量相同的烧瓶,分别编号为 1~6,加入规格、质量相同的铁丝。
② 向 1~3 号瓶中放入 2mL 清水,向 4~6 号瓶中放入 2mL10%X 的水溶液,将铁丝润湿。
③ 塞上带有导管的塞子,将导管末端浸入盛有水的烧杯中,记录导管内液面的初始位置(如图所示)。
④ 放在室温环境下,每隔一小时测量一次,周期为 3 小时,记录数据。结果如下表所示:
时间(小时) | 1 号瓶 | 2 号瓶 | 3 号瓶 | 4 号瓶 | 5 号瓶 | 6 号瓶 |
0 | 0 | 0 | 0 | 0 | 0 | 0 |
1 | 0 | 0.1 | 0 | 1.2 | 1.4 | 0 |
2 | 0.8 | 0.7 | 0.9 | 5.6 | 5.7 | 0.1 |
3 | 3.5 | 3.2 | 3.7 | 9.8 | 10.0 | 0.1 |
注:放置过程中导管内液面上升情况(单位:cm)
(1)在该项探究中,要取同样处置的 3 只烧瓶的目的是_。
(2)6 号瓶的数据明显与 4、5 号瓶不同,可能原因是_。
(3)通过本实验,可初步得出的结论是_。
(4)该项探究的设计是否存在不足_?如何改进_?
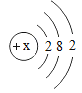
【题目】下表是不同温度下硝酸钾的溶解度,下列有关说法正确的是
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A.20°C时,100 g硝酸钾饱和溶液中含硝酸钾的质量是31.6g
B.接近饱和的硝酸钾溶液可通过升高温度的方法变为饱和溶液
C.60°C时,将60g硝酸钾固体在50g水中溶解,可得到110g的硝酸钾溶液
D.将80°C时硝酸钾饱和溶液降温至20°C,此时硝酸钾溶液溶质的质量分数约为24%