题目内容
【题目】根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 | 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
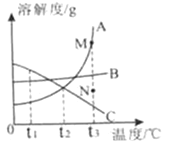
(1)随温度升高, Ca(OH)2溶解度的变化趋势是_____(填“增大”“减小”或“不变”)。
(2)根据上表推断硝酸钾和氯化钠溶解度相等时的温度范围是_____。
(3)如图1所示,试管中盛有25℃时的硝酸钾饱和溶液,欲使硝酸钾饱和溶液变为不饱和溶液可采取的方法有_____(填序号)。
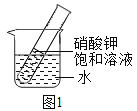
①向试管中加入水 ②向烧杯中加入氢氧化钠固体
③向烧杯中加入生石灰 ④将溶液倒出一部分⑤向烧杯中加入硝酸铵
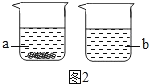
(4)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时有如图2所示的实验现象,烧杯b中溶解的物质是_____(填化学式),两烧杯内的溶液为饱和溶液的是_____(填序号)。
【答案】减小 20℃![]() 40℃ ①②③ NaCl ab
40℃ ①②③ NaCl ab
【解析】
(1)由表格数据可知,随温度升高, Ca(OH)2溶解度的变化趋势是减小。
(2)20℃时硝酸钾的溶解度小于氯化钠,40℃是硝酸钾的溶解度大于氯化钠,根据推断硝酸钾和氯化钠溶解度相等时的温度范围是:20℃![]() 40℃;
40℃;
(3)如图1所示,试管中盛有25℃时的硝酸钾饱和溶液,欲使硝酸钾饱和溶液变为不饱和溶液可采取的方法有:
①向试管中加入水,溶解质量变大,溶液变为不饱和溶液;
②向烧杯中加入氢氧化钠固体放热,烧杯温度升高,导致试管温度升高,硝酸钾溶液度变大,变为不饱和溶液;
③向烧杯中加入生石灰放热,烧杯温度升高,导致试管温度升高,硝酸钾溶液度变大,变为不饱和溶液;
④将溶液倒出一部分,依然是饱和溶液;
⑤向烧杯中加入硝酸铵吸热,烧杯温度降低,导致试管温度降低,硝酸钾溶解度变小,依然是饱和溶液;
故选:①②③;
(4)20℃时,硝酸钾的溶解度为31.6g,氯化钠的溶解度为36g,取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时烧杯b中固体全部溶解,则溶解的物质是氯化钠(NaCl),a烧杯中有固体剩余,是硝酸钾溶液;此时两烧杯内的溶液都为饱和溶液;
故选:a和b。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案