题目内容
28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g.计算:原混合物中钠元素的质量分数.(已知:AgNO3+NaCl=AgCl↓+NaNO3;计算结果精确到1%)
解:生成沉淀的质量是:(28.7g+100g+134g)-234 g=28.7 g
设混合物中氯化钠的质量是x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 28.7 g
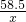 =
=
解得x=11.7g
则原混合物中硝酸钠的质量是 28.7g-11.7g=17g
设氯化钠中钠元素的质量是y,硝酸钠中钠元素的质量是z
NaCl~Na Na NO3 ~Na
58.5 23 85 23
11.7g y 17g z
 =
=
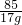 =
=
y=4.6g z=4.6g
所以原混合物中钠元素的质量分数是 ×100%≈32%
×100%≈32%
答:原混合物中钠元素的质量分数是32%.
分析:根据质量守恒定律求出氯化银的质量,然后根据氯化银的质量求出生成硝酸钠的质量,再依据关系式法求出钠元素的质量,再求原混合物中钠元素的质量分数.
点评:掌握化学方程式的计算格式和规范性,并能根据题目所给信息细心分析解答是解题的关键.
设混合物中氯化钠的质量是x
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5
x 28.7 g
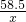 =
=
解得x=11.7g
则原混合物中硝酸钠的质量是 28.7g-11.7g=17g
设氯化钠中钠元素的质量是y,硝酸钠中钠元素的质量是z
NaCl~Na Na NO3 ~Na
58.5 23 85 23
11.7g y 17g z
 =
=
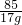 =
=
y=4.6g z=4.6g
所以原混合物中钠元素的质量分数是
 ×100%≈32%
×100%≈32%答:原混合物中钠元素的质量分数是32%.
分析:根据质量守恒定律求出氯化银的质量,然后根据氯化银的质量求出生成硝酸钠的质量,再依据关系式法求出钠元素的质量,再求原混合物中钠元素的质量分数.
点评:掌握化学方程式的计算格式和规范性,并能根据题目所给信息细心分析解答是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目