题目内容
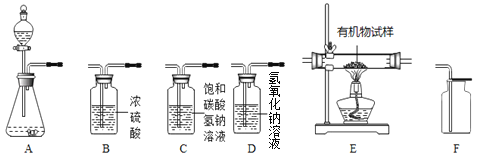
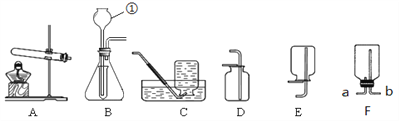
【题目】实验室制取气体所需装置如下图所示:
请回答以下问题:
(1)写出仪器①的名称____________;
(2)实验室选用B装置制取氧气的化学方程式是__________________________________;B装置的优点是_______(填序号):
①一次制取较多气体 ② 随时添加液体药品 ③随开随用,随关随停
(3)要收集到较为纯净的氧气应该选择的收集装置为__________ (填字母)
(4)若选F装置用排空气法收集甲烷,空气应从______(选填“a” 或“b”)排出。
【答案】 长颈漏斗 2H2O2![]() 2H2O+O2↑ ①② C a
2H2O+O2↑ ①② C a
【解析】根据所学知识和题中信息知,(1)仪器①的名称是长颈漏斗。(2)实验室选用B装置制取氧气的化学方程式是2H2O2![]() 2H2O+O2↑。B装置的优点是 ①一次制取较多气体 和 ② 随时添加液体药品。(3)要收集到较为纯净的氧气应该选择的收集装置为C。﹙4)若选F装置用排空气法收集甲烷,空气应从a排出。
2H2O+O2↑。B装置的优点是 ①一次制取较多气体 和 ② 随时添加液体药品。(3)要收集到较为纯净的氧气应该选择的收集装置为C。﹙4)若选F装置用排空气法收集甲烷,空气应从a排出。
点睛∶本题主要考查实验室制取氧气的装置,原理,收集方法等操作。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】研究盐类物质的性质时,甲、乙、丙三位同学分别向NaHCO3溶液中滴加石灰水,均产生白色沉淀.他们分别设计实验方案,对自己过滤后的滤液中溶质的成分进行如下探究.一、定性研究
【实验准备】用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
加入酚酞溶液 | 溶液变红 | 现象Ⅰ | 溶液变红 |
加入CuSO4溶液 | 产生气泡和蓝色沉淀 | 现象Ⅱ | 产生气泡和蓝色沉淀 |
加入CaCl2溶液 | 无明显变化 | 无明显变化 | 产生白色沉淀 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 | 澄清石灰水无明显变化 |
表中的现象Ⅰ为__________;现象Ⅱ为产生蓝色沉淀,对应反应的化学方程式是_________________________。
【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是NaOH和Ca(OH)2.丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是__________________。
②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是_________。
(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,加入过量的__________的溶液 | 有白色沉淀生成 | 滤液中的溶质是Na2CO3和NaOH |
过滤,向滤液中滴加______溶液 | _____________________ |
(3)结合此次探究活动,你认为下列说法正确的是_________(填字母序号)。
a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量。
二、定量分析
已知碳酸钠稳定而碳酸氢钠(NaHCO3)不稳定,碳酸氢钠受热易分解,反应的化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O有NaHCO3和Na2CO3混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体.将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀.如果将剩余固体溶于足量的稀盐酸,会产生多少克CO2 ?____________
Na2CO3+CO2↑+H2O有NaHCO3和Na2CO3混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体.将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀.如果将剩余固体溶于足量的稀盐酸,会产生多少克CO2 ?____________