题目内容
【题目】金属与人类生活密切相关,回答下列问题。
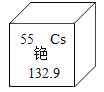
(1)铯原子钟300年误差不超过5秒。铯元素在元素周期表中的信息如图所示,则铯的相对原子质量是 _________。
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:纯铜_______黄铜(填“>”或“=”或“<”).
(3)金属资源储量有限,而且不可再生。下列措施能够减缓金属消耗速度的是_______。
A回收利用废旧金属 B加大对金属矿物的开采,提高金属产量
C寻找和开发金属的替代品 D提高金属制品的防腐能力,延长金属制品的使用寿命
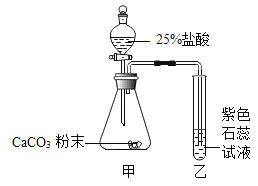
(4)铁是目前世界产量最高的金属,但易生锈,写出用稀盐酸除铁锈的化学方程式______________。
(5)往硝酸银溶液中加入一定量的锌和铜的混合物,充分反应后,过滤,滤液为蓝色,则滤液中一定含有的金属离子是___________。
【答案】132.9 < ACD ![]() Zn2+、Cu2+
Zn2+、Cu2+
【解析】
(1)在元素周期表中,元素名称下方的数字表示相对原子质量,故铯的相对原子质量是132.9;
(2)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,说明黄铜片的硬度大,故填:<;
(3)A、回收利用废旧金属,可以实现资源的有效利用,减少金属资源的消耗,节约金属资源,符合题意;
B、加大对金属矿物的开采,提高金属产量,会造成资源浪费,不利于减缓金属消耗速率,不符合题意;
C、寻找和开发金属的替代品,可以减少金属资源的消耗,保护金属资源,符合题意;
D、提高金属制品的防腐能力,延长金属制品的使用寿命,可以保护金属资源,减少金属资源的消耗,符合题意。
故选ACD;
(4)铁锈的主要成分是氧化铁,氧化铁能与稀盐酸反应生成氯化铁和水,该反应的化学方程式为:![]() ;
;
(5)往硝酸银溶液中加入一定量的锌和铜的混合物,金属活动性:Zn>Cu>Ag,故锌先与硝酸银反应生成硝酸锌和银,待锌完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后,过滤,滤液为蓝色,说明铜已经与硝酸银发生了反应,而铜可能与硝酸银恰好完全反应,或铜过量,这时滤液中含有的金属离子是:Zn2+、Cu2+,铜也可能置换了部分硝酸银,这时滤液中含有的金属离子是:Zn2+、Cu2+、Ag+,故滤液中一定含有的金属离子是:Zn2+、Cu2+。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】钢铁的腐蚀是重要研究课题。
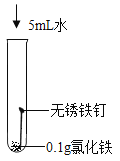
(知识回顾)用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
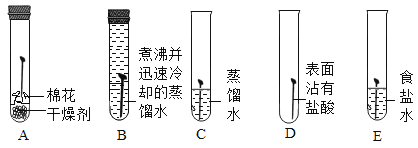
(1)由A、B、C的现象可知,铁的锈蚀是铁跟________________(填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是________________。
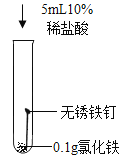
(实验探究)向试管D中(含生锈铁钉)加人过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式:________________。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。
序号 | 实验I | 实验Ⅱ | 实验Ⅲ |
实验内容 |
|
|
|
现象 | 溶液颜色始终呈黄色 | 产生红褐色沉淀 | 溶液逐渐由黄色变浅绿色 |
①设计实验I的目的是________________。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是__________。
(拓展延仲)研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
(5)如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是___________________。

(6)如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是________________。