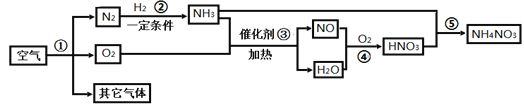
题目内容
【题目】10℃时,将3g甲、乙两种可溶性固体分别放入盛有10mL水的试管中。两种物质的溶解情况(见图I),两种物质的溶解度随温度的变化(见图Ⅱ)。下面对甲、乙两物质的判断,不正确的是
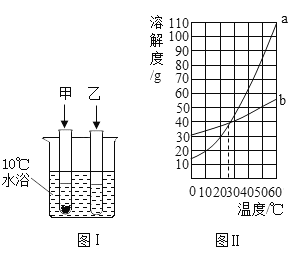
A.10℃时,甲、乙两物质的溶液都是饱和溶液
B.温度升高至25℃时,甲、乙两物质的溶液都是不饱和溶液
C.甲物质对应的溶解度曲线为a
D.可用降温结晶法分离甲、乙两种物质的混合物
【答案】A
【解析】
A、10mL水合10g水,10℃时,根据曲线b,一种物质的溶解度大于30g,10g水溶解该物质的最大质量大于3g,此时该物质的溶液不是饱和溶液,说法错误;
B、温度升高至25℃时,甲、乙两物质的溶解度均为40g,10g水最多可以溶解甲、乙均为4g>3g,此时甲、乙两物质的溶液都是不饱和溶液,说法正确;
C、根据图1,10℃时,甲物质未全部溶解,可知此时甲溶解度小于乙,观察曲线a、b,甲物质对应的溶解度曲线为a,说法正确;
D、甲物质溶解度受温度影响变化较大,乙物质溶解度受温度影响不大,可用降温结晶法分离甲、乙两种物质的混合物,说法正确;
故选:A。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
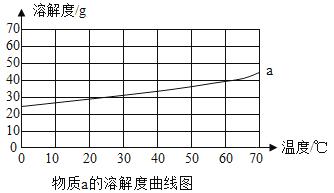
普通高中同步练习册系列答案【题目】a、b是常见的两种固体物质,根据图表的信息回答下列问题:
物质b的溶解度表
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
b的溶解度/g | 14 | 20 | 30 | 45 | 65 | 85 | 110 |
(1)60℃时,物质a的溶解度是______g。
(2)20℃时,将20g物质b加入到50g水中,充分溶解后得到溶液的质量为________g。
(3)将50℃时a、b两物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数大小关系为a______b(填“>”、“=”或者“<”)。
(4)下列说法正确的组合是_______(填字母序号)。
①所有物质的溶解度都随温度的升高面增大
②30℃时,物质的溶解度a小于b
③物质b中含有少量a时,可以采用降温结晶的方法提纯b
④40℃时,分别将物质a、b的饱和溶液降温至10℃,析出物质的质量b大于a
A ①④
B ①③
C ②③
D ②④
【题目】有位化学教师在实验室取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂(如图)。某化学兴趣小组的同学在该老师的指导下,对该生石灰样品开展了以下探究活动。
(提出问题)生石灰样品的成分是什么?
(作出猜想)生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
(实验探究)小华同学设计如下实验进行探究。
实验 | 实验操作 | 实验现象 | 实验结论 |
① | 取样品于烧杯中,加水溶解,用手触摸烧杯壁。 | 烧杯壁发热 | _____ |
② | 将①中液体过滤,取少量滤液于试管中,向其中滴入_____。 | 溶液变红 | 有Ca(OH)2 |
③ | 取②中的少许滤渣于试管中,向其中滴加少量稀盐酸。 | _____ | 无CaCO3 |
(交流讨论)
(1)同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2,理由是_______。
(2)小红同学提出实验③结论也不正确。他改进实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进实验③的操作内容是_________。
(3)通过小组合作,最后得出样品中肯定含有CaO和CaCO3,可能含有Ca(OH)2。请写出生成CaCO3的化学方程式_________。
(反思应用)
(1)生石灰要________保存。
(2)设计和分析实验时,要充分考虑反应物的量和生成物等因素对实验结论的干扰。
(3)要确定样品中是否含有氢氧化钙,还需要学习更多化学知识才能解决。