题目内容
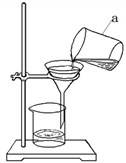
【题目】化学课外活动小组的某位同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下:

请回答下列问题:
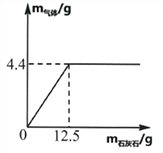
(1)该同学制得氧气的质量为_______g。
(2)计算滤液中溶质质量分数____________。(忽略水的损耗,写出计算过程)
【答案】 4.8 14.9%
【解析】(1)根据质量守恒定律可以计算出反应生成氧气的质量;(2)根据反应的化学方程式求算氯酸钾的质量,从而求出滤液中溶质质量分数即可。(1)根据质量守恒,减少的质量就是生成的氧气的质量,即制得氧气:15.5g-10.7g=4.8g;(3)设生成氯化钾的质量为x。
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
149 96
x 4.8g![]()
x=7.45g
滤液中溶质质量分数为![]() ×100%=14.9%
×100%=14.9%
答:滤液中溶质质量分数为14.9%。

练习册系列答案
相关题目
【题目】下图为采用“数字化”实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标Y表示烧杯中的某个量。下列对物质X与纵坐标Y的分析正确是
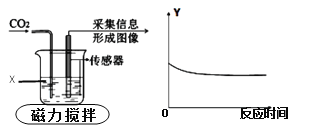
选项 | 物质X | 纵坐标Y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶质的质量 |
D | 氢氧化钙溶液 | 溶液中钙元素质量 |
A. A B. B C. C D. D