题目内容
【题目】实验设计是化学实验的重要环节.化学兴趣小组的同学们利用蜡烛和烧杯进行了以下探究,请回答有关问题. 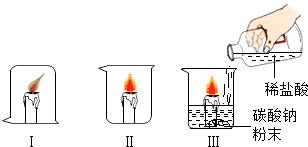
(1)观察I中蜡烛燃烧情况,与其灭火原理相同的生活实例是;
(2)利用干冰也可以使杯中蜡烛熄灭,向烧杯中加入干冰时用到的仪器是 , 蜡 烛熄灭的原因是;
(3)Ⅲ中现象是 , 有关反应的化学方程式是;
(4)【提出问题】不改变Ⅲ中化学反应原理及装置,如何让蜡烛快速熄灭?
【设计方案】方法①:将碳酸钠粉末配制成碳酸钠溶液;
方法②:;
(5)【观察现象】方法①和②中蜡烛均能快速熄灭;
【分析与结论】方法①中蜡烛很快熄灭的微观解释是;
(6)【反思与交流】由上述实验可知影响化学反应快慢的因素有: .
【答案】
(1)油锅着火用锅盖盖灭
(2)镊子;干冰升华吸热,使温度降到蜡烛的着火点以下同时二氧化碳能隔绝氧气
(3)有大量气泡产生,白色粉末逐渐减少,蜡烛熄灭;Na2CO3+2HCl═2NaCl+CO2↑+H2O
(4)将稀盐酸换成浓盐酸
(5)钠离子和碳酸根离子分散到水分子中间,使反应物充分接触
(6)反应物的浓度和反应物之间的接触面积
【解析】(1)I中蜡烛是隔绝氧气灭火,如油锅着火用锅盖盖灭,故填:油锅着火用锅盖盖灭(合理即可);(2)干冰是固体,用镊子夹取,干冰易升华吸热,造成温度降低,低于蜡烛的着火点,同时二氧化碳不燃烧也不支持燃烧而熄灭,故填:镊子;干冰升华吸热,使温度降到蜡烛的着火点以下同时二氧化碳能隔绝氧气;(3)碳酸钠与稀盐酸反应生成二氧化碳气体,二氧化碳不燃烧也不支持燃烧,所以蜡烛熄灭,烧杯底发生的反应是碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,方程式是Na2CO3+2HCl═2NaCl+CO2↑+H2O,故填:有大量气泡产生,白色粉末逐渐减少,蜡烛熄灭;Na2CO3+2HCl═2NaCl+CO2↑+H2O;(4)【设计方案】增大了反应物的浓度,反应速率就会加快,故填:将稀盐酸换成浓盐酸;(5)【分析与结论】方法①中蜡烛很快熄灭的原因是钠离子和碳酸根离子分散到水分子中间,使反应物充分接触.故填:钠离子和碳酸根离子分散到水分子中间,使反应物充分接触(合理即可);(6)【反思与交流】由上述实验可知影响化学反应快慢的因素有:反应物的浓度和反应物之间的接触面积,故填:反应物的浓度和反应物之间的接触面积(合理即可).
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

