题目内容
(7分)菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某学习小组进行了实验研究。取10g菱镁矿,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如下表:
说明:菱镁矿中的杂质不溶于水,不与酸发生反应。.
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)

(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
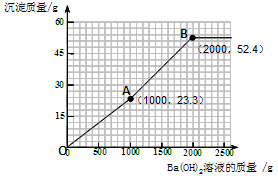
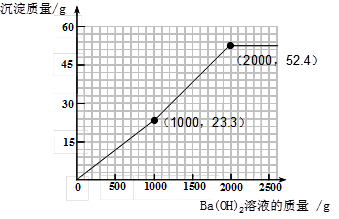
(4)为避免溶液排放对环境的影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了l.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
| 加入H2S04溶液的质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(1)10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为 。
(2)计算该菱镁矿中镁元素的质量分数。(写出计算过程)

(3)该实验研究中所用H2SO4溶液的溶质的质量分数是 。
(4)为避免溶液排放对环境的影响,某同学对上述反应后溶液进行了过滤,并在滤液中加入了l.71%的Ba(OH)2溶液。请你画出加入Ba(OH)2溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标中作图,并标出曲线折点的坐标)
(1)4.4g
(2)菱镁矿中镁元素的质量分数为24%。
(3)9.8%
(4)作图见下图曲线
(2)菱镁矿中镁元素的质量分数为24%。
(3)9.8%
(4)作图见下图曲线

试题分析:(1)碳酸镁可与稀硫酸反应生成二氧化碳气体,氢氧化钠可与二氧化碳气体反应。所以氢氧化钠溶液增重的质量即为反应生成的二氧化碳的质量。由于氢氧化钠溶液增重的质量最大值为4.4g。所以生成CO2的质量为4.4g。
(2)根据题意可知:已知量为生成二氧化碳的质量;未知量为菱镁矿中镁元素的质量分数。解题思路:可根据二氧化碳与碳酸镁在反应体系中的质量关系,求出碳酸镁的质量。再进一步可计算出菱镁矿中镁元素的质量分数。具体过程如下:
解:设菱镁矿中MgCO3的质量为x。
MgCO3+H2SO4=MgSO4+H2O+CO2↑
84 44
x 4.4g
84∶44=x∶4.4g
x = 8.4g
菱镁矿中镁元素的质量分数=[(8.4g×24/84)÷10g]×100%=24%
答:该菱镁矿中镁元素的质量分数为24%。
(3)根据表格中的数据可知:第一、二两次中的硫酸完全反应,所以可根据第一、二两次中二氧化碳的质量计算出参加反应的硫酸的质量,进一步计算出硫酸的质量分数。具体过程如下:
解:设所用H2SO4溶液的溶质的质量分数为y
MgCO3+H2SO4=MgSO4+H2O+CO2↑
98 44
100gy 4.4g
98:44=100gy:4.4g
y = 9.8%
所用H2SO4溶液的溶质的质量分数为9.8%。
(4)加入的氢氧化钡可先与过量的稀硫酸反应。由于过量的稀硫酸中硫酸的质量为(200g—100g)×9.8%= 9.8g。根据反应的化学方程式可计算出:可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g。所以图像中的第一个折点的坐标为(1000,23.3 )。
再加入的氢氧化钡与硫酸镁反应。根据反应的化学方程式可计算出:硫酸镁的质量为12 g,可恰好反应掉氢氧化钡溶液的质量为1000g,同时生成硫酸钡沉淀的质量为23.3 g,生成氢氧化镁沉淀的质量为5.8 g。因此图像中的第二个折点所用的氢氧化钡溶液的质量为1000 g+1000 g=2000 g。同时沉淀的质量为23.3 g+23.3 g+5.8 g=52.4 g。所以图像中的第二个折点的坐标为(2000,52.4)。
再加入氢氧化钡时,不再产生沉淀。可根据规律进行描点和画图为:

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目