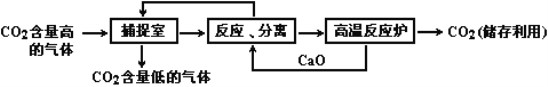
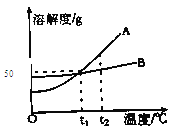
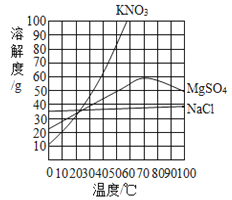
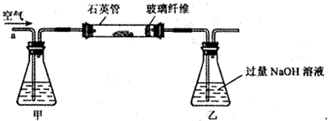
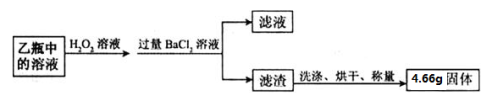
题目内容
【题目】下列四个实验中只需要完成三个就可以证明铁、铜、银三种金属的活动性顺序。其中不必进行的是
A.将铁片放入稀盐酸中 B.将铜片放入稀硫酸中
C.将铁片放入硝酸银溶液 D.将铜片放入硝酸银溶液
【答案】C
【解析】
试题分析:探究金属的活动性强弱,可利用的原理:1、金属与酸反应,观察是否会反应或反应的激烈程度,2、金属与盐溶液反应,结合A、将铁片放入稀盐酸中和B、将铜片放入稀硫酸中,可判断铁的活动性比铜要强,D、将铜片放入硝酸银溶液,铜能将银置换出来,可证明铜的活动性比银要强,即可排出铁、铜、银三种金属的活动性顺序,故选C

练习册系列答案
相关题目