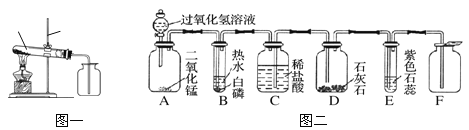
题目内容
【题目】(5分)A、B两物质的溶解度曲线如图所示,请根据曲线回答下列问题
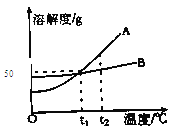
(1)t1℃时,A的饱和溶液中溶质与溶液质量比
(2)、若B中含有少量A,应用 法提纯B;
(3)、若将A的饱和溶液从t2℃降温到t1℃时,一定不会发生改变的是 。
A.溶解度 B.溶剂质量 C.溶质质量 D.溶质质量分数
(4)看下图可知,20 ℃时NaCl的溶解度为36 g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为 ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是
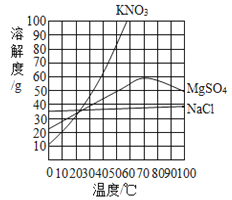
【答案】(1)1:3 (2)蒸发溶剂 (3)B
(4)10 不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料。(合理即可)
【解析】
试题分析:(1)t1℃时,A物质溶解度为50克,则A的饱和溶液中溶质与溶液质量比=1:3
(2)B物质溶解度受温度影响变化较小,若B中含有少量A,提纯B应选用蒸发结晶法;
(3)A、影响固体溶解度的主要因素是温度,温度改变,物质溶解度一定发生变化,错误;B、A的饱和溶液从t2℃降温到t1℃时,A的溶解度变小,但溶剂质量未发生改变,正确;C、溶质质量减小,错误;D、溶质质量分数减小,错误。故选B
(4)20 ℃时NaCl的溶解度为36 g,则本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为10克,根据密度公式可知10克水的体积为10ml;增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是不利于后续蒸发溶剂,蒸发溶剂时间会大大延长,消耗燃料

练习册系列答案
相关题目